lithium
| ejendomme | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Generelt | |||||||||||||||||||
| Navn , symbol , atomnummer | Litium, Li, 3 | ||||||||||||||||||
| Element kategori | Alkalimetaller | ||||||||||||||||||
| Gruppe , periode , blok | 1 , 2 , s | ||||||||||||||||||
| Udseende | sølvhvid / grå | ||||||||||||||||||
| CAS -nummer | |||||||||||||||||||
| EF -nummer | 231-102-5 | ||||||||||||||||||
| ECHA InfoCard | 100.028.274 | ||||||||||||||||||
| Massefraktion af jordens kuvert | 60 ppm 27. Frekvens | ||||||||||||||||||
| Atomar | |||||||||||||||||||
| Atommasse | 6,94 (6,938-6,997) og lignende | ||||||||||||||||||
| Atomradius (beregnet) | 145 (167) pm | ||||||||||||||||||
| Kovalent radius | 128 pm | ||||||||||||||||||
| Van der Waals radius | 182 kl | ||||||||||||||||||
| Elektronkonfiguration | [ Han ] 2 s 1 | ||||||||||||||||||
| 1. Ioniseringsenergi | 5.391 714 95 (4) eV ≈ 520.22 kJ / mol | ||||||||||||||||||
| 2. Ioniseringsenergi | 75.640 096 4 (13) eV ≈ 7 298.16 kJ / mol | ||||||||||||||||||
| 3. Ioniseringsenergi | 122.454 358 1 (8) eV ≈ 11 815.05 kJ / mol | ||||||||||||||||||
| Fysisk | |||||||||||||||||||
| Fysisk tilstand | fast | ||||||||||||||||||
| Ændringer | 1 | ||||||||||||||||||
| Krystalstruktur | kropscentreret kubik | ||||||||||||||||||
| massefylde | 0,534 g / cm 3 (20 ° C ) | ||||||||||||||||||
| Mohs hårdhed | 0,6 | ||||||||||||||||||
| magnetisme | paramagnetisk ( Χ m = 1,4 10 −5 ) | ||||||||||||||||||
| Smeltepunkt | 453,69 K (180,54 ° C) | ||||||||||||||||||
| kogepunkt | 1603 K (1330 ° C) | ||||||||||||||||||
| Molær volumen | 13,02 · 10 −6 m 3 · mol −1 | ||||||||||||||||||
| Fordampningsvarme | 136 kJ / mol | ||||||||||||||||||
| Fusionsvarme | 3 kJ mol −1 | ||||||||||||||||||
| Lydens hastighed | 6000 m s −1 ved 293,15 K. | ||||||||||||||||||
| Specifik varmekapacitet | 3482 J kg −1 K −1 | ||||||||||||||||||
| Arbejdsfunktion | 2,9 eV | ||||||||||||||||||
| Elektrisk ledningsevne | 10,6 · 10 6 A · V −1 · m −1 | ||||||||||||||||||
| Varmeledningsevne | 85 W m −1 K −1 | ||||||||||||||||||
| Kemisk | |||||||||||||||||||
| Oxidationstilstande | +1 | ||||||||||||||||||
| Normalt potentiale | -3,04 V | ||||||||||||||||||
| Elektronegativitet | 0,98 ( Pauling skala ) | ||||||||||||||||||
| Isotoper | |||||||||||||||||||
| |||||||||||||||||||
| For andre isotoper se liste over isotoper | |||||||||||||||||||
| NMR egenskaber | |||||||||||||||||||
| |||||||||||||||||||
| Sikkerhedsinstruktioner | |||||||||||||||||||
| |||||||||||||||||||
|
Så vidt muligt og sædvanligt anvendes SI -enheder . Medmindre andet er angivet, gælder de givne data for standardbetingelser . | |||||||||||||||||||
Lithium (afledt af oldtidens græske λίθος Lithos , tysk 'sten' , udtale [ liːti̯ʊm ] eller også [ liːʦi̯ʊm ]) er et grundstof med symbolet Li og atomnummer 3. Det er et element af 1. IUPAC-gruppen , gruppen af alkalimetaller og tilhører den anden periode i elementernes periodiske system . Litium er et letmetal og har den laveste massefylde af faste elementer under standardbetingelser .
Litium forekommer ikke elementært i naturen på grund af dets høje reaktivitet. Ved stuetemperatur er den kun stabil i lang tid i fuldstændig tør luft, men den reagerer langsomt for at danne lithiumnitrid (Li 3 N). I fugtig luft dannes der hurtigt et matgråt lithiumhydroxidlag på overfladen . Som alle alkalimetaller reagerer elementær lithium i kontakt med hudens fugtighed og fører dermed til alvorlige kemiske forbrændinger og forbrændinger . I modsætning til de tilsvarende natrium- og kaliumforbindelser mærkes mange lithiumforbindelser, der danner lithiumioner i vandig opløsning, som skadelige.
Som et sporelement er lithium i form af dets salte en almindelig komponent i mineralvand . Små mængder lithium er til stede i den menneskelige organisme ; elementet er imidlertid ikke essentielt og har ingen kendt biologisk funktion. Nogle lithiumsalte har imidlertid en medicinsk virkning og bruges i litiumterapi til bipolære affektforstyrrelser , mani , depression og klyngehovedpine (se medicin ).
historie

Discoverer of lithium Swede anvender Johan August Arfwedson, at i 1817 tilstedeværelsen af et fremmed element i petalit (Li [4] Al [4] [Si 4 O 10 ]) og kort tid efter i spodumene (LiAl [Si 2 O 6 ]) og lepidolit (K (Li, Al) 3 [(Al, Si) 4 O 10 ] (F, OH) 2 ), da han analyserede mineralfund fra øen Utö i Sverige . Hans akademiske lærer Jacob Berzelius foreslog lithion , en afledning af de græske λίθος lithos 'sten', som et navn, der, ifølge navnene på de to andre alkalimetaller natrium og kalium er kendt på det tidspunkt, indikerer det materiale, som det var ekstraheret. Den latiniserede form for lithium har sejret.
I 1818 bemærkede den tyske kemiker Christian Gottlob Gmelin, at litiumsalte giver en rød flammefarve . Begge forskere mislykkedes forsøg på at isolere dette element i de følgende år. I 1818 lykkedes William Thomas Brande og Sir Humphry Davy for første gang at bruge en elektrolytisk proces fra lithiumoxid (Li 2 O). I 1855 producerede Robert Bunsen og Augustus Matthiessen store mængder rent lithium ved elektrolysering af lithiumchlorid (LiCl). I 1917 syntetiserede Wilhelm Schlenk de første organolitiumforbindelser fra organiske kviksølvforbindelser .
Med den første kommercielle produktion i 1923 begyndte tyskeren Metallgesellschaft i Hans-Heinrich Hut i Langelsheim i harpiks ved en smeltning af lithium og kaliumchlorid (KCl) elektrolyse var.
Indtil kort efter Anden Verdenskrig var der næsten ingen anvendelser for lithium bortset fra dets anvendelse som smøremiddel (mineralolie, fortykket med lithiumstearat ) og i glasindustrien ( lithiumcarbonat eller lithiumoxid ). Det ændrede sig, da USA havde brug for tritium , som kan ekstraheres fra lithium, for at lave brintbomber . En bred produktion begyndte, især i Kings Mountain, North Carolina . På grund af de store mængder af lithium kræves på grund af den korte tritium halveringstid , blev et stort udbud af lithium akkumuleret mellem 1953 og 1963, som først blev bragt på markedet fra 1993 efter afslutningen af den kolde krig . Udover minedrift blev billigere ekstraktion fra saltlage nu også vigtig. Større mængder lithium bruges nu til batterier , til polymerisation af elastomerer , i byggeindustrien og til organisk syntese af lægemidler og landbrugskemikalier. Siden 2007 har primære batterier og akkumulatorer ( sekundære batterier ) været det vigtigste segment.
Forekomst og minedrift
Forekomst på jorden
Litium har en andel på omkring 0,006% af jordskorpen . Det forekommer noget sjældnere end zink og oftere end kobolt , tin og bly i jordskorpen. Selvom lithium for eksempel er mere almindeligt end bly, gør dets større distribution det svært at opnå. Litium findes i drikkevand og nogle fødevarer som kød, fisk, æg og mejeriprodukter. 100 g kød indeholder omkring 100 μg lithium. Forskellige planter som tobak eller smørblomst absorberer lithiumforbindelser fra jorden og beriger dem. Den gennemsnitlige andel af plantens tørstof er mellem 0,5 ppm og 3 ppm. Havvand indeholder i gennemsnit 180 µg / L og flodvand omkring 3 µg / L.
Udtømning og reserver
Volumenmæssigt blev 35.000 tons lithium ekstraheret uden for USA i 2015 og hovedsageligt handlet som lithiumcarbonat (Li 2 CO 3 ). I 2016 var Chile den største producent. Australien tredobler sin produktion mellem 2016 og 2017 og øgede den igen med næsten 50% i 2018. I øjeblikket (2018) udvindes næsten to tredjedele af litiumreserverne i Australien fra minedrift fra hård sten og kun omkring en tredjedel fra saltlage. De reserver i de eksisterende miner er anslået til omkring 17 millioner tons (fra januar 2020). Verdens aflejringer fra kontinentale saltlage, geotermiske saltlage, fra hectoritmineralet, oliefeltslage og fra den vulkanske stenpegmatit er blevet anslået til 80 millioner tons.
De største ressourcer er i Bolivia (21 millioner tons), Argentina (17 millioner tons), Chile (9 millioner tons), USA (6,8 millioner tons), Australien (6,3 millioner tons) og Kina (4,5 millioner tons). I Europa har Tyskland (2,5 millioner tons) og Tjekkiet (1,3 millioner tons) de største forekomster.
| Verdensomspændende produktion [tons] | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 (anslået) | Mine reserver | Verdens indskud |
|---|---|---|---|---|---|---|---|---|
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 9.000.000 | 21.000.000 |
|
|
11.500 | 10.500 | 14.300 | 14.200 | 17.000 | 18.000 | 8.600.000 | 9.000.000 |
|
|
2.300 | 2.000 | 2.300 | 6.800 | 7.100 | 7.500 | 1.000.000 | 4.500.000 |
|
|
13.300 | 14.100 | 14.000 | 40.000 | 58.800 | 42.000 | 2.800.000 | 6.300.000 |
|
|
3.200 | 3.600 | 5.800 | 5.700 | 6.400 | 6.400 | 1.700.000 | 17.000.000 |
|
|
300 | 200 | 400 | 800 | 800 | 1.200 | 60.000 | 250.000 |
|
|
160 | 200 | 200 | 200 | 300 | 300 | 95.000 | 400.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 630.000 | 6.800.000 |
|
|
900 | 900 | 1.000 | 800 | 1.600 | 1.600 | 230.000 | 540.000 |
|
|
n. v. | n. v. | n. v. | n. v. | 2.400 | 200 | 370.000 | 1.700.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 3.000.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.000.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.000.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.700.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 50.000 |
| verden | 31.700 | 31.500 | 38.000 | 69.000 | 95.000 | 77.000 | 17.000.000 | 80.000.000 |
Primære indskud
Lithium forekommer i nogle mineraler i lithium pegmatites . De vigtigste mineraler er amblygonit (LiAl [PO 4 ] F), lepidolit (K (Li, Al) 3 [(Al, Si) 4 O 10 ] (F, OH) 2 ), petalit (hjul; LiAl [Si 4 O 10 ]) og spodumene (triphane; LiAl [Si 2 O 6 ]). Disse mineraler har et lithiumindhold på op til 9% (for amblygonit). Andre, mere sjældne lithiummalme er kryolit -ionit (Li 3 Na 3 [AlF 6 ] 2 ), som har det højeste lithiumindhold af alle mineraler, triphylin (Li (Fe II , Mn II ) [PO 4 ]) og zinnwaldit (K ( li, Fe, Al) 3 [(Al, Si) 4 O 10 ] (F, OH) 2 ). Litiummineraler findes i mange silikat - sten før, men normalt kun i lave koncentrationer. Der er ingen store indskud. Da ekstraktion af lithium fra disse mineraler er forbundet med stor indsats, spiller de i dag en underordnet rolle i ekstraktionen af lithium eller lithiumforbindelser, men dette kan ændre sig på grund af den forventede store efterspørgsel. De vigtigste ekstraktionssteder er Greenbushes og Mt. Cattlin-miner i det vestlige Australien , i hvis pegmatitsten der er en høj koncentration af lithium, og hvor lithium er et biprodukt af tantalekstraktion . Også i nogle andre lande som Canada og Rusland , indtil 1998 også i Bassemer City , North Carolina , udvindes spodumen til litiumproduktion .
Europa har Li-rige pegmatitmarker på Weinebene i Kärnten i Wolfsberg-distriktet , i den finske region Østerbotten , i Erzgebirge og mellem Spanien ( Almendra ) og Portugal ( Guarda-distriktet , Boticas ).
Mens den første kommercielle produktion af litiumforbindelser i sig selv begyndte i Harzen allerede i 1923, kunne produktionen i de nyudviklede vigtige aflejringer i Østrig og Finland starte fra 2021. De drives af Global Strategic Metals eller Keliber . I Østrig på Koralpe i Lavanttal har testtunneler vist en meget større forekomst af lithiumholdig grund, der anslås til 22 millioner tons. Dette gør det til et af de første store litiummineprojekter i Europa og kan drives i 20 år. Forekomsten nær Zinnwald i Ertsbjergene undersøges af Deutsche Lithium .
Sekundære indskud
Litiumsalte, især lithiumchlorid , findes også bredt i saltlage, hovedsagelig salt søer . Koncentrationen kan være op til en procent. Ud over koncentrationen af lithium er forholdet mellem magnesium og lithium vigtigt for kvaliteten af saltlage. I øjeblikket bruges lithium hovedsageligt i Chile ( Salar de Atacama , der har 0,16% med den højeste kendte litiumkoncentration), Argentina ( Salar de Hombre Muerto ), USA ( Silver Peak , Nevada) og Folkerepublikken Kina ( Chabyêr Caka , Tibet; Taijinaier -søen , Qinghai). Den bolivianske saltsø Salar de Uyuni med anslået 5,4 millioner tons lithium er muligvis den største ressource. Det statsejede selskab Yacimientos de Litio Bolivianos har siden 2018 investeret med tyske og kinesiske partnere i sin industrialisering, herunder naboer Salar de Coipasa og Laguna Pastos Grandes . Der er andre litiumholdige saltsøer, der (fra april 2019) endnu ikke bruges til industriel minedrift, for eksempel i Kina, Argentina og Afghanistan . I 2016 blev det kendt, at i Paradox-bassinet i den amerikanske delstat Utah blev der stødt på højt saltvand dybt grundvand ( saltlage ) i olieefterforskningsbrønde allerede i 1960'erne , hvorfra der ifølge analyser dengang var op til 1700 mg / L ren lithium kunne opnås.
Kaliumcarbonat (potaske), borax , cæsium og rubidium opnås ofte som biprodukter produkter i lithium produktion .
På grund af den forventede stærke efterspørgsel efter lithium til batterier i elektriske køretøjer undersøgte nogle virksomheder i 2010 minedrift af lithiumholdige mineraler og saltlage i forskellige regioner i verden, herunder Europa. Udvinding af lithium fra havvand undersøges også. Ca. 230 milliarder tons lithium opløses i verdenshavene. I 2018 præsenterede forskere en ekstraktionsmetode, hvor lithium kan hentes fra havvand ved hjælp af soldrevet elektrolyse . De anførte en fordel i forhold til konventionel ekstraktion, at metallisk lithium opnås direkte i processen, og derfor kan den (komplekse og energikrævende) videre behandling undværes, som det er nødvendigt ved traditionel lithiumekstraktion fra malme.
På Leibniz Institute for New Materials startede det toårige MERLIN-forskningsprojekt ( minedrift af lithiumudvinding ) i november 2020 , hvormed ekstraktion af lithium fra minevand skal testes.
Forekomst uden for jorden
Efter Big Bang blev der ud over hydrogen- og heliumisotoper dannet en betydelig mængde af de 7 Li isotop . Det meste af dette er ikke længere tilgængeligt i dag, for i stjerner blev lithium smeltet med brint i processen med proton-protonreaktionen II og blev dermed forbrugt. Hos brune dværge er massen og temperaturen imidlertid ikke høj nok til brintfusion; deres masse når ikke den nødvendige størrelse på cirka 75 Jupitermasser . Litium produceret under Big Bang blev derfor kun bevaret i større mængder i brune dværge. Af denne grund er lithium også et relativt sjældent element uden for jorden , men det kan bruges til at opdage brune dværge.
Distributionen af lithium i forskellige stjerner er meget forskellig, selvom alder, masse og metallicitet er ens. Det menes, at planeter har indflydelse på lithiumindholdet i en stjerne. Hvis en stjerne ikke har nogen planeter, er lithiumindholdet højt, mens stjerner som solen, som er omgivet af planeter, kun har et lavt lithiumindhold, som også er kendt som lithiumdip . Årsagen menes at være, at planternes tidevands kræfter bidrager til en stærkere blanding af ydre og indre lag i stjerner, så mere lithium kommer ind i et område, der er varmt nok til at smelte det sammen.
Produktions proces
Litium opnås hovedsageligt fra saltvand (grundvand, saltsøer) ved fordampning. Ekstraktion fra sten i minedrift er en sjælden gang .
Fra saltvand
For at udtrække lithium pumpes salt grundvand til overfladen og ledes gennem en kæde af fordampningsdamme, hvor fordampning i solen finder sted over flere måneder. Når lithiumchloridet har nået den nødvendige koncentration i damme, pumpes opløsningen ind i et forarbejdningsanlæg, hvor uønsket bor eller magnesium ekstraheres og filtreres fra. Derefter behandles det med natriumcarbonat . Det udfældede lithiumcarbonat filtreres og tørres. Overskydende saltlage pumpes tilbage i saltsøen. I tørre områder som Chile fremmer brugen af grundvand udtørringen af landskabet.
skildring
Lithiumcarbonat udfældes fra lithiumholdige saltopløsninger ved fordampning af vandet og tilsætning af natriumcarbonat (sodavand) . For at gøre dette koncentreres saltlagen først i luften, indtil lithiumkoncentrationen overstiger 0,5%. Det svagt opløselige lithiumcarbonat udfældes ved tilsætning af natriumcarbonat:
- .
For at opnå metallisk lithium omsættes lithiumcarbonatet først med saltsyre . Dette skaber kuldioxid , der slipper ud som en gas, og opløses lithiumchlorid . Denne opløsning koncentreres i en vakuuminddamper, indtil chloridet krystalliserer:
Apparater og systemer til ekstraktion af lithiumchlorid skal være fremstillet af specialstål eller nikkellegeringer , da saltlage er meget ætsende . Metallisk lithium er smeltet saltelektrolyse af en ved 450-500 ° C smeltende eutektisk blanding af 52 vægtprocent lithiumchlorid og 48 vægtprocent kaliumchlorid blev fremstillet:
Kalium aflejres ikke under elektrolysen, fordi det har et lavere elektrodepotentiale i chloridsmeltningen . Spor af natrium aflejres imidlertid også og gør lithium særligt reaktivt (fordelagtigt inden for organisk kemi, dårligt for Li -batterier). Det flydende lithium samler sig på elektrolytoverfladen og kan således relativt let udlades fra elektrolysecellen. Det er også muligt at opnå lithium ved at elektrolysere lithiumchlorid i pyridin . Denne metode er særligt velegnet på en laboratorieskala.
Økonomisk betydning og handel med råvarer
Efter ekstraktion, lithium når de forarbejdning industrier som et råmateriale via handel . I råvarehandel , især på markederne for metaller , handles der ikke rent lithium, det ville være kemisk ustabilt. I stedet forhandles stabile lithiumforbindelser, dvs. d. Normalt med lithiumsalte eller lithium-baserede krystalbunker, overvejende lithiumcarbonat eller lithiumhydroxidmonohydrat . Disse stoffer er bl.a. handlet på London Metal Exchange . I 2020 blev der registreret en pris på 8,75 USD / kg for lithiumcarbonat (minimumsindhold 99,5%) og en pris på 10,25 USD / kg for lithiumhydroxidmonohydrat (minimumsindhold 56,5%).
Ud over at citere lithium som råmateriale, lithium indeksfonde har (ETF) eksisteret siden 2010 , der kan handles på børsen. Disse ETF'er kortlægger markedsværdien af virksomheder, der er involveret i litiumværdikæden. Siden 2010 er der en bestand ydeevne indeks af Solactive , som sporer kursværdi af de største børsnoterede selskaber, der deltager i efterforskning og udvinding af lithium og produktionen af lithium-batterier. De ti største værdier i dette indeks inkluderer (i faldende størrelsesorden fra april 2020): Albemarle , SQM , Tesla , BYD , Samsung , Simplo Technology , LG Chem , Panasonic , GS Yuasa og Enersys . De få litium -ETF'er sporer for det meste dette indeks.
ejendomme
Fysiske egenskaber
Litium er et sølvhvidt, blødt letmetal . Det er det letteste af alle faste elementer ved stuetemperatur ( densitet 0,534 g / cm³). Kun fast brint ved -260 ° C er endnu lettere med en massefylde på 0,0763 g / cm³.
Ligesom de andre alkalimetaller krystalliserer lithium i en kropscentreret kubisk pakning af kugler i rumgruppen Im 3 m (rumgruppe nr. 229) med gitterparameteren a = 351 pm og to formelenheder pr . Celleenhed . Ved lave temperaturer på 78 K, ændrer krystalstrukturen ved spontan transformation i en sekskantet struktur magnesium typen med gitterparametrene a = 311 pm og c = 509 pm eller efter deformation i et kubisk struktur af kobberet type (kubisk ansigts- centreret) med gitterparameteren a = 438 pm kl. De nøjagtige årsager til, hvilken struktur der dannes, er ukendte.
Af alkalimetallerne har lithium det højeste smelte- og kogepunkt samt den største specifikke varmekapacitet . Litium har den største hårdhed af alle alkalimetaller, men med en Mohs -hårdhed på 0,6 kan den stadig skæres med en kniv. Som et typisk metal er det en god leder af elektricitet (ledningsevne: ca. 18% kobber) og varme.
Litium ligner stort set magnesium , hvilket også afspejles i udseendet af heterotypiske blandede krystaller af lithium og magnesium, den såkaldte isodimorfisme . Selvom magnesium krystalliserer i den sekskantede nærmeste pakning, mens lithium krystalliserer i den kropscentrerede kubiske pakning, er begge metaller stort set heterotypisk blandbare. Dette finder dog kun sted i et begrænset koncentrationsområde, hvor den komponent, der er til stede i overskydende grad "påtvinger" sit krystalgitter på de andre.
Lithium ion har den højeste enthalpi hydratisering af alle alkalimetalioner på -520 kJ / mol . Som et resultat er det fuldt hydreret i vand og tiltrækker stærkt vandmolekylerne. Den lithium former to hydrat, en indre med fire vandmolekyler, som er meget kraftigt bundet via deres oxygenatomer til lithiumion, og en ydre skal, i de ovennævnte hydrogenbindinger flere vandmolekyler med Li [H 2 O] 4 + ion er forbundet. Som følge heraf er ionradien for den hydrerede ion meget stor, endda større end den for de tunge alkalimetaller rubidium og cæsium , som ikke har så stærkt bundne hydratiseringsskaller i vandig opløsning.
Som en gas forekommer lithium ikke kun i individuelle atomer, men også i molekylær form som Dilithium Li 2 . Single-bond lithium når derved et fuldt atomært kredsløb og dermed en energisk gunstig situation. Dilithium har en bindingslængde på 267,3 pm og en bindingsenergi på 101 kJ / mol. I gasform er ca. 1% (efter masse) af lithium til stede som dilithium.
Kemiske egenskaber
Ligesom alle alkalimetaller er lithium meget reaktivt og reagerer let med et stort antal elementer og forbindelser (såsom vand ) og afgiver varme . Det er imidlertid det mindst reaktive af alkalimetallerne. Et særligt træk, der adskiller lithium fra andre alkalimetaller, er dets reaktion med molekylært nitrogen for at danne lithiumnitrid , som finder sted langsomt, selv ved stuetemperatur:
- .
Dette muliggøres af Li + -ionens høje ladningstæthed og dermed af lithiumnitridets høje gitterenergi . Med -3,04 V har lithium det laveste normale potentiale i det periodiske system og er derfor det mindst ædle af alle grundstoffer.
Ligesom alle alkalimetaller opbevares lithium under råolie eller paraffinolie , ellers reagerer det med ilt og nitrogen i luften.
Da ionradierne for Li + og Mg 2+ ioner er sammenligneligt store, er der også ligheder i egenskaberne af lithium- eller lithiumforbindelser og magnesium- eller magnesiumforbindelser. Denne lighed i egenskaberne af to elementer fra nabogrupper i det periodiske system er kendt som et skråt forhold i det periodiske system . I modsætning til natrium danner lithium mange organometalliske forbindelser ( organolithiumforbindelser ), såsom butyllithium eller methyllithium . Lignende forhold eksisterer mellem beryllium og aluminium og mellem bor og silicium .
Isotoper
De to stabile isotoper 6 Li (7,6%) og 7 Li (92,4%) forekommer i naturen . Derudover kendes ustabile isotoper, der starter ved 4 Li til 8 Li til 12 Li, som kun kan fremstilles kunstigt. Deres halveringstider er alle i millisekundintervallet .
6 Li spiller en vigtig rolle inden for atomfusionsteknologi. Det fungerer både i atomfusionsreaktoren og i brintbomben som udgangsmateriale til produktion af tritium , som er nødvendigt for den energiproducerende fusion med deuterium . Tritium dannes i tæppet i fusionsreaktoren eller i brintbomben ved siden af helium ved at bombardere 6 Li med neutroner, der opstår under fusionen, efter atomreaktionen
- .
Den reaktion, der også er mulig
er mindre egnet (se tæppe ) . Den adskillelse kan finde sted, for eksempel via en isotop udveksling af lithium amalgam og et opløst lithiumforbindelse (såsom lithiumchlorid i ethanol) (såkaldt Colex proces ). Udbytter på omkring 50% opnås.
Hvis der i en tretrinsbombe også er 7 Li ud over 6 Li (som det var tilfældet for eksempel med Castle Bravo ), reagerer dette med nogle af de hurtige neutroner, der genereres under fusionen. Dette skaber neutroner igen, samt helium og yderligere tritium. Selvom den 7 Li-neutronreaktion i første omgang forbruger energi, er slutresultatet en øget frigivelse af energi gennem yderligere fusioner og mere nuklear fission i uranbombeskallen . Eksplosionsstyrken er derfor højere, end hvis kun den 6 Li del af isotopblandingen var blevet omdannet i bomben. Da det før Castle Bravo -testen blev antaget, at de 7 Li ikke ville reagere med neutronerne, var bomben omkring 2,5 gange så kraftig som forventet.
Litiumisotopen 7 Li produceres i små mængder i atomkraftværker gennem en atomreaktion af borisotopen 10 B (brugt som neutronabsorber) med neutroner.
Isotoperne 6 Li, 7 Li bruges begge i forsøg med kolde kvantegasser . Sådan blev det første Bose-Einstein-kondensat med ( boson ) isotop 7 Li skabt. 6 Li er derimod en fermion , og i 2003 var det muligt at omdanne molekyler af denne isotop til et superfluid .
brug
Den vigtigste og hurtigst voksende applikation for lithium i dag er dens anvendelse i lithium-ion-akkumulatorer (ofte også omtalt som genopladelige batterier ). B. i smartphones , bærbare computere , batteriværktøjer eller elektrisk betjente køretøjer såsom hybridbiler , elbiler eller e-cykler (se diagram til højre). De fleste af de producerede lithiumsalte reduceres ikke til metal, men bruges enten direkte som lithiumcarbonat, lithiumhydroxid, lithiumchlorid, lithiumbromid eller omdannes til andre forbindelser. Metallet er kun påkrævet i nogle applikationer. De vigtigste anvendelser af lithiumforbindelser findes i afsnittet " Forbindelser ".
metal
Noget af det producerede lithiummetal bruges til ekstraktion af lithiumforbindelser, der ikke kan fremstilles direkte fra lithiumcarbonat. Disse er primært organiske lithiumforbindelser, såsom butyllithium , lithium-hydrogenforbindelser, såsom lithiumhydrid (LiH) eller lithiumaluminiumhydrid og lithiumamid .
Litium bruges til at fjerne nitrogen fra gasser på grund af dets evne til at reagere direkte med nitrogen .
Metallisk lithium er et meget kraftfuldt reduktionsmiddel ; det reducerer mange stoffer, der ikke reagerer med andre reduktionsmidler. Det bruges til delvis hydrogenering af aromater ( birkreduktion ). I metallurgi bruges det til afsvovling , deoxidation og afkolning af metalsmeltninger.
Da litium har et meget lavt normalpotentiale , kan det bruges som en anode i batterier . Disse litiumbatterier har en høj energitæthed og kan generere en særlig høj spænding . De ikke-genopladelige litiumbatterier må ikke forveksles med de genopladelige lithium-ion-akkumulatorer, hvor litiummetaloxider som lithiumkoboltoxid er forbundet som katoden og grafit eller andre forbindelser, der opbevarer lithiumioner som anoden.
Kernefusion
Det tritium, der kræves til drift af atomfusionsreaktorer, skal fremstilles i tæppet i lithium-6-reaktoren.
Legeringskomponent
Litium er legeret med nogle metaller for at forbedre deres egenskaber. Små mængder lithium er ofte tilstrækkelige til dette. Som en blanding forbedrer det trækstyrke , hårdhed og elasticitet i mange materialer . Et eksempel på en lithiumlegering er skinnemetal , en blylegering med cirka 0,04% lithium, der bruges som bæremateriale i jernbaner. De mekaniske egenskaber ved magnesium-lithiumlegeringer og aluminium-lithiumlegeringer forbedres også ved tilsætning af lithium. På samme litiumlegeringer er meget lette og er derfor meget i luft- og rumteknologi, der bruges.
Forskning (atomfysik)
I atomare fysik , er lithium anvendes ofte, fordi med 6 Li det er den eneste alkalimetal med en stabil fermioniske isotop , hvorfor det er egnet til at forske effekterne i ultrakolde fermioniske kvantegasser (se BCS teorien ). Samtidig har den en meget bred Feshbach -resonans , som gør det muligt at justere spredningslængden mellem atomerne efter ønske, hvorved magnetfelterne ikke skal holdes særlig præcise på grund af resonansens bredde .
medicin
Litium blev først brugt i vestlig medicin som et middel mod gigt allerede i 1859 . Det viste sig dog at være ineffektivt. Det var først i 1949, at den australske psykiater John Cade (1912–1980) beskrev et muligt anvendelsesområde for lithiumsalte. Han havde injiceret marsvin med forskellige kemiske forbindelser, herunder lithiumsalte, hvorefter de reagerede mindre kraftigt på ydre stimuli og blev roligere, men ikke søvnige. I eftertid viste det sig, at den effekt, der blev observeret hos forsøgsdyrene, skyldtes forgiftning. Efter et selvforsøg af Cade blev brugen af lithiumcarbonat som et lægemiddel til behandling af maniodepressive patienter undersøgt i en dobbeltblind undersøgelse på Psykiatrisk Hospital i Risskov (Danmark) fra 1952 til 1954 . Dette lagde grundlaget for litiumterapi .
I dette bruges lithium i form af salte, såsom lithiumcarbonat , mod bipolar affektforstyrrelser , mani og depression, men også uden for psykiatrien til behandling af klyngehovedpine eller infektioner med herpes simplex . Det lave terapeutiske område skal bemærkes, der er mellem 0,6 mmol / L og 0,8 mmol / L, og spejlbestemmelser gør det nødvendigt under behandlingen. Selv når lithiumblodniveauet er ved den øvre grænse for det terapeutiske område, kan håndterbare, reversible bivirkninger forekomme hos følsomme mennesker. Men hvis lithiumblodniveauet er et godt stykke over det terapeutiske område - dvs. over 2,0 mmol / L - øges risikoen for betydelige til alvorlige bivirkninger som tremor , strenghed , kvalme, opkastning, hjertearytmier og leukocytose hurtigt. Over 3,5 mmol / L er der fare for liv. Årsagen er, at metabolismen af lithium og natrium er ens. For store lithiumniveauer kan skyldes svedtendens eller natriumskylende lægemidler (natriuretiske diuretika ) med faldende natriumniveauer. Kroppen forsøger at kompensere for natriumtabet ved at trække natrium fra den primære urin i nyrerne og transportere det tilbage i blodet ( natriumretention ). Udover natrium bevares også lithium, som normalt udskilles jævnt af nyrerne. Resultatet er et øget lithiumniveau, som kræver lægemiddelovervågning, når der tages lithium , hvor litiumniveauet regelmæssigt bestemmes og dosis justeres i overensstemmelse hermed. Selv med den korrekte dosering kan langvarig behandling med lithium føre til vand- og natriumtab ( diabetes insipidus ), overforsuring af blodet ( acidose ) og lithiumnephropati med nedsat nyrefunktion .
En undersøgelse offentliggjort i USA i 1990 beskriver en betydelig reduktion i kriminalitet og selvmord i regioner med forhøjede lithiumkoncentrationer i drikkevand . En østrigsk undersøgelse kom til lignende resultater.
Lithiums virkemåde som et psykotropisk lægemiddel er endnu ikke undersøgt tilstrækkeligt. Især diskuteres i øjeblikket indflydelse på inositolmetabolismen ved at hæmme myo-inositol-1 phosphatase ( enzymklasse 3.1.3.25) og hæmme glykogensyntasekinase-3 (GSK-3) i nerveceller som mulige mekanismer. Den antidepressive virkning af lithium er sandsynligvis også baseret på en stigning i serotonerg neurotransmission, dvs. en øget frigivelse af serotonin i synapserne , mens den antimaniske effekt forklares ved en hæmning af dopaminerge receptorer. En anden interessant effekt af lithiumsalte på mennesker og pattedyr som rotter er den sandsynligvis relaterede ændring i døgnrytmen . Denne effekt er endda blevet påvist i planter som Kalanchoe . Andre serotonerge stoffer som LSD , mescalin og psilocybin viser også sådanne virkninger hos mennesker. Ved hjælp af litium er det lykkedes dyreforsøg på frugtfluer ( Drosophila melanogaster ) at bekæmpe symptomer på Alzheimers sygdom - såsom glemsomhed. I regioner med højere lithiumniveauer synes demens at være mindre udbredt. Den neurobeskyttende virkning skyldes muligvis den litiumforstærkede autofagi .
Aldersforskeren Michael Ristow viste i 2011 en mulig forbindelse mellem lithiumindholdet i miljøet og menneskets forventede levetid: i en japansk befolkningsundersøgelse var der en statistisk signifikant sammenhæng mellem et højere indhold af lithium og en højere forventet levetid; Desuden forlængede høje lithiumkoncentrationer levetiden for nematoden og modelorganismen Caenorhabditis elegans . På grund af de mange virkninger på menneskers sundhed diskuteres det, om lithium kan være et sporelement .
bevis
Lithiumforbindelser viser en karminrød flammefarve , de karakteristiske spektrale linjer er hovedlinjerne ved 670.776 og 670.791 nm; mindre linjer er ved 610,3 nm. Desuden kan lithium detekteres ved hjælp af flammefotometri .
En kvantitativ påvisning med våde kemiske metoder er vanskelig, da de fleste lithiumsalte er letopløselige. En mulighed er gennem udfældning af det letopløselige lithiumphosphat . Til dette formål er den prøve, der skal undersøges gjort alkalisk med natronlud, fx , og en lille dinatriumhydrogenphosphat Na 2 HPO 4 tilsættes. Ved opvarmning dannes der et hvidt bundfald i nærvær af Li + :
En anden mulighed er at bruge jernperjodatreagenset .
Advarsler om fare
Elementært lithium i form af metalstøv antændes i luften selv ved normal temperatur. Af denne grund skal metallisk lithium også opbevares uden luft, normalt i råolie . Ved højere temperaturer over 190 ° C dannes overvejende lithiumoxid umiddelbart ved kontakt med luft. I ren ilt antændes lithium fra omkring 100 ° C. I en ren nitrogenatmosfære reagerer lithium kun hurtigere på lithiumnitrid ved højere temperaturer. Litium kan reagere eksplosivt, når det kommer i kontakt med stoffer, der indeholder ilt eller halogen.
Da lithium reagerer stærkt eksotermisk med almindelige brandslukningsmidler som vand , kuldioxid , nitrogen eller det nu forbudte carbontetrachlorid , brande med inerte gasser som z. B. argon eller andre metalbekæmpelsesmidler såsom salt (z. B. NaCl) kan slukkes.
Elementær lithium, som alle alkalimetaller , forårsager skader gennem forbrændinger eller alkaliske kemiske forbrændinger ved hudkontakt, fordi det danner lithiumhydroxid med vand og afgiver stærk varme; hudens fugtighed er tilstrækkelig til dette.
links
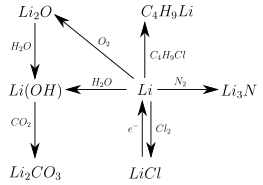
Litium er meget reaktivt og danner forbindelser med de fleste ikke-metaller , hvor det altid er i + I- oxidationstilstanden . Disse har som regel en ionisk struktur, men i modsætning til forbindelser af andre alkalimetaller har de et højt kovalent indhold. Dette kan blandt andet ses ved, at mange lithiumsalte - i modsætning til de tilsvarende natrium- eller kaliumsalte - er letopløselige i organiske opløsningsmidler, såsom acetone eller ethanol . Kovalente organiske lithiumforbindelser findes også. Mange lithiumforbindelser ligner i deres egenskaber de tilsvarende magnesiumforbindelser på grund af de lignende ioniske radier ( skråt forhold i det periodiske system ). Følgende grafik giver en oversigt over de vigtigste reaktioner ved lithium. Støkiometrien og præcise reaktionsbetingelser tages ikke i betragtning her:
Hydrogenforbindelser
Hydrogen danner hydrider med lithium . Den enkleste lithium-brintforbindelse lithiumhydrid LiH stammer fra elementerne ved 600–700 ° C. Det bruges som raketbrændstof og til hurtig fremstilling af hydrogen, f.eks til oppustning life jakker . Der er også mere komplekse hydrider, såsom lithiumborhydrid LiBH 4 eller lithiumaluminiumhydrid LiAlH 4 . Sidstnævnte er af stor betydning i organisk kemi som en selektiv hydrogendonor, for eksempel til reduktion af carbonyl- og nitroforbindelser .
Litiumdeuterid (LiD) og litiumtritid (LiT) spiller en vigtig rolle i forskning i atomfusion . Da rent lithiumdeuterid reducerer brintbombens energi, bruges en blanding af LiD og LiT til dette. Disse faste stoffer er lettere at håndtere end tritium med sin hurtige effusionshastighed .
Iltforbindelser
Med ilt danner lithium både lithiumoxid Li 2 O og lithiumperoxid Li 2 O 2 .
Når lithium reagerer med vand, dannes lithiumhydroxid , en stærk base. Lithiumhydroxid bruges til fremstilling af lithiumfedt, der bruges som smørefedt til biler. Da lithiumhydroxid også binder kuldioxid, bruges det til at regenerere luften i ubåde.
Flere lithiumforbindelser
Lithium danner salte af formen LiX med halogeniderne. Disse er lithiumfluorid , lithiumchlorid , lithiumbromid og lithiumiodid . Da lithiumchlorid er meget hygroskopisk, bruges det også som tørremiddel, udover at det bruges som udgangsmateriale til fremstilling af lithium. Det bruges til at tørre gasser, for eksempel naturgas , før det føres gennem rørledningen eller i klimaanlæg til at reducere luftfugtigheden (op til 2% relativ luftfugtighed). Litiumchlorid bruges også til at sænke smeltetemperaturer, i svejse- og loddebade og som svejseelektrodebeklædning til svejsning af aluminium. Lithiumfluorid bruges som en enkelt krystal i infrarød spektroskopi .
Den teknisk vigtigste lithiumforbindelse er det letopløselige lithiumcarbonat . Det bruges til at ekstrahere de fleste andre lithiumforbindelser og bruges som flux i glasindustrien og til fremstilling af emalje . Det bruges også i aluminiumsproduktion til at forbedre smeltets ledningsevne og viskositet.
Litiumsæber er litiumsalte af fedtsyrer . De anvendes hovedsagelig som fortykningsmiddel i høj kvalitet råolie- baseret smørefedt og voks og til fremstilling af blyanter .
Andre lithiumsalte er:
- Lithiumperchlorat LiClO 4 ,
- Litiumsulfat Li 2 SO 4 ,
- Lithiumnitrat lino 3 , anvendes med kaliumnitrat i gummiindustrien til vulkanisering ,
- Lithiumnitrid Li 3 N, dannes når lithium reagerer med nitrogen,
- Litiumniobat LiNbO 3 , er transparent i en lang række bølgelængder og bruges i optik og til lasere ,
- Lithiumamid LiNH 2 , er en stærk base og dannes, når lithium reagerer med flydende ammoniak .
- Lithiumstearat C 18 H 35 LiO 2 , er et vigtigt additiv for olier for at kunne bruges som smørefedt. Disse bruges i biler, valseværker og landbrugsmaskiner. Lithiumstearater er meget sparsomt opløselige i vand, så smørefilmen bevares, når de kommer i kontakt med lidt vand. De opnåede smørefedte har fremragende temperaturstabilitet (> 150 ° C) og forbliver smørende ned til -20 ° C.
- Lithiumacetat C 2 H 3 LiO 2
- Litiumcitrat C 6 H 5 Li 3 O 7
- Lithiumhexafluorphosphat LiPF 6 bruges som ledende salt i lithium-ion-batterier.
- Lithiumphosphat Li 3 PO 4 anvendes som katalysator til isomerisering af propylenoxid.
- Lithium metaborate LiBO 2 og lithium tetraborat Li 2 B 4 O 7
- Lithiumbromid LiBr er et reagens til fremstilling af lægemidler, men det bruges også i absorptionskøleanlæg .
Organiske lithiumforbindelser
I modsætning til de fleste andre alkalimetalorganyler spiller lithiumorganyler en betydelig rolle, især inden for organisk kemi. Af særlig betydning er n- butyllithium , tert- butyllithium , methyllithium og phenyllithium , som også er kommercielt tilgængelige i form af deres opløsninger i pentan, hexan, cyclohexan eller, hvis det er relevant, diethylether. Du kan ved direkte reaktion af metallisk lithium med alkyl / arylhalogenider iflg
eller ved transmetalering, for eksempel fra organylkviksølv ifølge
fremstille.
Med elementært lithium i tetrahydrofuran (THF) i stedet for magnesium i diethylether kan Grignard- analoge additionsreaktioner af alkylhalogenider til carbonylforbindelser normalt udføres med bedre udbytter.
På grund af sin klart kovalente karakter kan strukturen af organyllithium kun sjældent beskrives ved en simpel Li - C -binding. Der er for det meste komplekse strukturer opbygget af dimeriske, tetrameriske eller hexameriske enheder eller polymere strukturer. Lithiumorganyler er stærkt reaktive forbindelser, hvoraf nogle antændes spontant i luften. De reagerer eksplosivt med vand. På grund af deres ekstreme basicitet reagerer de også med opløsningsmidler, hvis bundne hydrogen næppe er sure, såsom THF , hvilket i høj grad begrænser valget af egnede opløsningsmidler. Reaktioner med dem er kun mulige under beskyttelsesgas og i tørrede opløsningsmidler. Derfor kræves en vis erfaring i håndteringen af dem, og der tilrådes stor forsigtighed.
En anden gruppe af organiske lithiumderivater er lithiumamider af typen LiNR 2 , hvoraf lithiumdiisopropylamid (LDA) og lithium bis (trimethylsilyl) amid ( LiHMDS , se også HMDS ) anvendes som stærke baser uden nukleofil aktivitet.
Lithiumorganyler anvendes på mange måder, for eksempel som initiatorer til anionisk polymerisation af olefiner, som metalliserende , deprotoniserende eller alkylerende midler .
De såkaldte Gilman cuprater af typen R 2 CuLi er af vis betydning .
litteratur
- AF Holleman , E. Wiberg , N. Wiberg : Lærebog i uorganisk kemi . 102. udgave. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1259-1270.
- NN Greenwood, A. Earnshaw: Elementernes kemi. 1. udgave. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9 , s. 83-129.
- M. Binnewies: Generel og uorganisk kemi. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0208-5 , s. 334–336.
- Ernst Henglein: Teknologi af ekstraordinære metaller. 1991, ISBN 3-8085-5081-3 .
- Harry H. Binder: Leksikon for de kemiske grundstoffer - det periodiske system i fakta, tal og data. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- Richard Bauer: Litium - som det ikke er i lærebogen. I: Kemi i vor tid . 19, nr. 5, 1985, s. 167-173, doi: 10.1002 / ciuz.19850190505 .
- NJ Birch: Uorganisk farmakologi for litium. I: Chem. Rev. 99, nr. 9, 1999, s. 2659-2682, PMID 11749496 .
- Jürgen Deberitz, Gernot Boche: Lithium og dets forbindelser - industriel, medicinsk og videnskabelig betydning. I: Kemi i vor tid . 37, nr. 4, 2003, s. 258-266, doi: 10.1002 / ciuz.200300264 .
- Michael Bauer, Paul Grof, Bruno Muller-Oerlinghausen (red.): Lithium in Neuropsychiatry: The Comprehensive Guide. 1. udgave. Informa Healthcare, 2006, ISBN 1-84184-515-9 .
Weblinks
- Resumé af alkalimetaller af wiley-vch (PDF; 2,2 MB)
Individuelle beviser
- ↑ a b c Harry H. Binder: Leksikon over de kemiske elementer . S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Værdierne for ejendommene (infoboks) er hentet fra www.webelements.com (lithium) , medmindre andet er angivet .
- ↑ Standardværdien anbefalet af IUPAC er angivet, da isotopsammensætningen af dette element kan variere lokalt, resulterer masseområdet angivet i parentes for den gennemsnitlige atomvægt. Se: Michael E. Wieser, Tyler B. Coplen: Atomiske vægte af elementerne 2009 (IUPAC Technical Report). I: Ren og anvendt kemi . 2010, s. 1, doi: 10.1351 / PAC-REP-10-09-14 .
- ^ IUPAC, standardatomvægte revideret 2013 .
- ↑ a b c Entry on lithium in Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Udg .: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Hentet 11. juni 2020.
- ↑ a b c Entry on lithium at WebElements, https://www.webelements.com , adgang til den 11. juni 2020.
- ^ NN Greenwood, A. Earnshaw: Elementernes kemi. 1. udgave. VCH, Weinheim 1988, ISBN 3-527-26169-9 , s. 97.
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129 til E-145. Værdier der er baseret på g / mol og angivet i cgs -enheder. Den her angivne værdi er SI -værdien beregnet ud fra den uden måleenhed.
- ^ A b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Korrigerede værdier for kogepunkter og entalpier ved fordampning af elementer i håndbøger. I: Journal of Chemical & Engineering Data . 56, 2011, s. 328-337, doi: 10.1021 / je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lærebog i eksperimentel fysik . Bind 6: faste stoffer. 2. udgave. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , s. 361.
- ↑ a b c d e f M. Hesse, H. Meier, B. Zeeh: Spektroskopiske metoder i organisk kemi . Thieme, 2002.
- ↑ a b c d Opslag om lithium i GESTIS -stofdatabasen i IFA , adgang til den 30. april 2017. (JavaScript kræves)
- ↑ indtastning på lithium i klassificeringer og mærkninger af det Europæiske Kemikalieagentur (ECHA), adgang den 1. august, 2016. Producenter eller forhandlere kan udvide den harmoniserede klassificering og mærkning .
- ↑ Wolfgang Pfeiler: kvanta, atomer, kerner, partikler. Walter de Gruyter GmbH & Co KG, 2017, ISBN 978-3-11-044571-8 , s.238 .
- ↑ Max Mangold: Udtaleordbogen (= The Duden i 12 bind. Bind 6). 6. udgave. 2005, ISBN 3-411-04066-1 , s. 514.
- ↑ Helmut de Boor , Hugo Moser, Christian Winkler (red.): Siebs: tysk udtale. Ren og moderat udtale med udtaleordbog . De Gruyter, Berlin 1969, s. 334 ( begrænset forhåndsvisning i Google bogsøgning).
- ↑ Duden online giver begge udtalevarianter, se lithium (med lydprøver fra ARD -udtaledatabasen).
- ↑ N. Figurowski: Opdagelsen af de kemiske grundstoffer og oprindelsen af deres navne . Aulis-Verlag Deubner, Köln 1981, ISBN 3-7614-0561-8 , s.135 .
- ^ Christoph Elschenbroich : Organometallchemie. 5. udgave. Teubner , Leipzig 2005, s.16 .
- ↑ a b Jessica Elzea Kogel: Industrielle mineraler og sten: råvarer, markeder og anvendelser. 7. udgave. SMV, 2006, ISBN 0-87335-233-5 , s. 599 ( Industrielle mineraler og sten i Google bogsøgning ).
- ↑ United States Geological Survey : Minerals Yearbook 2007: Lithium . (PDF; 75 kB), 2007.
- ↑ a b c Hans Breuer : dtv-Atlas Chemie. Bind 1, 9. udgave. Deutscher Taschenbuch Verlag (dtv), München 2000, ISBN 3-423-03217-0 .
- ↑ a b Lithium - en spændingsskabende på kredsløbskurset. ( Memento fra 17. juli 2011 i internetarkivet ) I: VDI nachrichten . 7. januar 2011, s.3.
- ↑ Onmeda Nutrient Lexicon , pr. 10. juni 2009.
- ↑ Peter Dolega, Matthias Buchert, Johannes Betz: Økologiske og socioøkonomiske udfordringer i batteri forsyningskæder: grafit og lithium . Kort undersøgelse oprettet som en del af BMBF -fællesprojektet Fab4Lib - forskning i foranstaltninger til at øge materiale- og proceseffektivitet i produktionen af lithium -ion battericeller langs hele værdikæden (FKZ 03XP0142E). Red.: Oeko-Institut. Freiburg, Darmstadt 29. juli 2020.
- ↑ a b c d e USGS [United States Geological Survey] (2020): Mineral Commodity Summaries 2020 - Lithium Data Sheet. URL: https://pubs.usgs.gov/periodicals/mcs2020/mcs2020-lithium.pdf (PDF; 130 kB) (adgang = 2020-09-07)
- ↑ Meridian International Research: Problemerne med Lithium 2. (PDF; 756 kB) Martainville, maj 2008.
- ^ Litiumforsyning i Portugal (2017).
- ^ LITHIUM potentialer i det nordlige Portugal (2004).
- ↑ Europæisk litium. Hentet 17. marts 2021 .
- ↑ Fremtidens guld: Kärnten lithiummine er ved at starte. Hentet 16. juli 2020 .
- ^ Zinnwald Lithium Project. Deutsche Lithium, adgang 17. marts 2021 .
- ↑ Zacharias Zacharakis: Litium: Bjerget vågner . I: Tiden . Hamburg 13. november 2017 ( zeit.de [adgang 5. december 2017]).
- ↑ Alix Arnold: Storslået landskab og eftertragtet råmateriale. Salar de Tunupa / Uyuni i Bolivia er rig på skønhed - og litium. I: ila. Journal of the Latin America Observatory . 395, Bonn, maj 2016, s. 38–39.
- ^ Stephan Bogner: Prima Diamond Corp. erhverver Green Energy -projektet i Utah med historiske lithiumkoncentrationer på 1700 mg / L. Rockstone Research, 18. februar 2015 ( PDF )
- ↑ Det hvide håb . I: FAZ . 27. januar 2011, s. 19.
- ^ Sixie Yang et al.: Lithium Metal Extraction from Seawater . I: Joule . 2018, doi : 10.1016 / j.joule.2018.07.006 .
- ^ Minevand som værdifuldt vand - minedrift møder elektromobilitet (INM pressemeddelelse)
- ↑ Hvor alt litium gik. På: Wissenschaft.de fra 15. august 2006. Observation af et fjernt stjernesystem bringer løsningen til en kosmologisk gåde.
- ↑ Om brune dværge .
- ^ Garik Israelian, Elisa Delgado Mena, Nuno C. Santos, Sergio G. Sousa, Michel Mayor, Stephane Udry, Carolina Domínguez Cerdena, Rafael Rebolo, Sofia Randich: Forbedret lithiumudtømning i sollignende stjerner med planeter i kredsløb. I: Naturen . Nr. 462, 2009, s. 189-191, doi: 10.1038 / nature08483 .
- ↑ Ulrich Wietelmann, Richard J. Bauer: lithium- og lithiumforbindelser . I: Ullmanns encyklopædi for industriel kemi . tape 21 , 2012, s. 344 , doi : 10.1002 / 14356007.a15_393 .
- ^ Terence Bell: En oversigt over kommerciel litiumproduktion. Balancen, 11. maj 2018, tilgås 16. december 2018 .
- ↑ zdf.de af 9. september 2018, E-Autos: En virksomhed, der kun ser ud til at være ren, især afsnittet med titlen “Lithium as a problematic raw material”, adgang til den 4. maj 2019.
- ↑ ARD: Kan elbilen redde miljøet?
- ^ Litium ved LME. lme.com internetportal (London Metal Exchange online), 2020, websted tilgået den 21. marts 2020.
- ↑ Clyde Smith: Avanceret batteriteknologi, lithium- og grafitmining -ETF’er: Global X Lithium & Battery Tech ETF (NYSE: LIT), Amplify Advanced Battery Metals (NYSE: BATT). born2invest.com internetportal, 10. april 2019 (engelsk)
- ↑ Solactive Global Lithium (SOLLIT). investing.com (UK) internetportal, adgang til webstedet 22. marts 2020
- ↑ Solactive Global Lithium Index , faktablad, pr. 2. april 2020.
- ↑ a b K. Schubert: En model for de kemiske grundstoffers krystalstrukturer. I: Acta Crystallographica . 30, 1974, s. 193-204, doi: 10.1107 / S0567740874002469 .
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Lærebog i uorganisk kemi . 91. - 100., forbedret og stærkt udvidet udgave. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3 , s. 928-931.
- ↑ lithium på webelements.com, fysiske egenskaber .
- ^ H. Malissa: Adskillelsen af lithium fra magnesium i lithium-magnesiumlegeringer. I: Fresenius 'Journal of Analytical Chemistry . 171, nr. 4, 1959, s. 281-282, doi: 10.1007 / BF00555410 .
- ↑ M. Binnewies: Generel og uorganisk kemi. Spektrum Verlag, 2006, s. 328.
- ^ Mark J. Winter : Kemisk binding. Oxford University Press, 1994, ISBN 0-19-855694-2 .
- ^ M. Binnewies: Generel og uorganisk kemi. Spektrum Verlag, 2006, s. 241.
- ↑ G. Audi, FG Kondev, Meng Wang, WJ Huang, S. Naimi: Den NUBASE2016 evaluering af nukleare egenskaber. I: Kinesisk Physics C . 41, 2017, s. 030001, doi: 10.1088 / 1674-1137 / 41/3/030001 ( fuld tekst ).
- ^ Richard Bauer: Litium - som det ikke er i ordbogen. I: Kemi i vor tid . 19, nr. 5, 1985, s. 167-173, doi: 10.1002 / ciuz.19850190505 .
- ↑ Rapport om brintbombetesten Castle Bravo (Engl.)
- ↑ Martin Volkmer: Grundlæggende viden om atomkraft. Inforum, 2006, ISBN 3-926956-44-5 , s. 39 ( PDF ( erindring af 17. juni 2012 i internetarkivet )).
- ↑ CC Bradley, CA Sackett, JJ Tollett, RG Hulet: Bevis for Bose-Einstein-kondens i en atomgas med attraktive interaktioner. I: Physical Review Letters . 75, nr. 9, 1995, s. 1687-1690, doi: 10.1103 / PhysRevLett.75.1687 .
- ↑ S. Jochim, M. Bartenstein, A. Altmeyer, G. Hendl, S. Riedl, C. Chin, J. Hecker Denschlag, R. Grimm: Bose-Einstein kondensering af molekyler. I: Videnskab . 302, nr. 5653, 2003, s. 2101-2103, doi: 10.1126 / science.1093280 .
- ↑ Script om batterier på TU Graz ( Memento fra 24. januar 2009 i internetarkivet ) (PDF; 3,4 MB).
- ↑ H. Gerdes: Lithium og Endocrinium . Springer, Berlin, Heidelberg 1978, ISBN 978-3-642-66830-2 , s. 29-83 , doi : 10.1007 / 978-3-642-66830-2_2 .
- ↑ J. Cade: Lithiumsalte til behandling af psykotisk spænding. I: Med. J. Australien. 36, 1949, s. 349-352. PMID 18142718 .
- ↑ T. Bschor: 66 års moderne psykofarmaceutisk terapi. I: Neurologi. 34, 2015, s. 710-714.
- ↑ M. Schou: Litiumbehandling af maniodepressiv sygdom. Thieme, 2001, ISBN 3-13-593304-0 .
- ↑ Litium ved bipolar lidelse - det er doseringen, der betyder noget! I: Lægeravis . 5. februar 2007, adgang til 6. september 2021 .
- ^ HD Mühlbauer: Litiumterapifordele , risici, alternativer: En introduktion til læger fra alle specialer . Springer, Berlin, Heidelberg 1986, ISBN 978-3-642-96935-5 , Die Lithiumintoxikation, s. 329-336 , doi : 10.1007 / 978-3-642-96935-5_31 .
- ^ R. Haussmann, M. Bauer, S. von Bonin, P. Grof, U. Lewitzka: Behandling af litiumforgiftning : står over for behovet for beviser . I: International Journal of Bipolar Disorders . tape 3 , nej. 1 , 2015, ISSN 2194-7511 , s. 23 , doi : 10.1186 / s40345-015-0040-2 , PMID 26493348 .
- ↑ Gerhard N. Schrauzer, Krishna P. Shrestha: Lithium i drikkevand og forekomsten af forbrydelser, selvmord, og arrestationer relateret til stofmisbrug. I: Biologisk sporstofforskning . 25. maj 1990, s. 105-113, PMID 1699579 .
- ↑ Nestor D. Kapusta, Nilufar Mossaheb, Elmar Etzersdorfer, Gerald Hlavin, Kenneth Thau, Matthäus Willeit, Nicole Praschak-Rieder, Gernot Sonneck, Katharina Leithner-Dziubas: Litium i drikkevand og selvmordsdødelighed . I: The British Journal of Psychiatry: The Journal of Mental Science . tape 198 , nej. 5 , 2011, ISSN 1472-1465 , s. 346-350 , doi : 10.1192 / bjp.bp.110.091041 , PMID 21525518 .
- ^ MJ Berridge: Inositol trisphosphat og diacylglycerol som andet budbringer. I: Biochemical Journal . 220, nr. 2, 1984, s. 345-360, PMC 1153635 (fri fuld tekst).
- ^ DH Carney, DL Scott, EA Gordon, EF LaBelle: Phosphoinositider i mitogenese: neomycininhiberer, thrombin-stimuleret phosphoinositidomsætning og initiering af celleproliferation. I: Celle . 42, nr. 2, 1985, s. 479-488, PMID 2992800 .
- ^ R. Williams, WJ Ryves, EC Dalton, B. Eickholt, G. Shaltiel, G. Agam, AJ Harwood: En molekylær cellebiologi af lithium. I: Biochem. Soc. Trans. 32, 2004, s. 799-802, doi: 10.1042 / BST0320799 .
- ↑ Psykiatrisk lægemiddelterapi .
- ↑ Brigitte Woggon : Behandling med psykofarmaka. Huber, Bern 1998, s. 77-84.
- ↑ T. Hafen, F. Wollnik: Virkning af lithiumcarbonat på aktivitetsniveauet og døgnrytmen periode i forskellige stammer af rotter. I: Farmakologi Biokemi og adfærd . 49, 1994, s. 975-983, PMID 7886116 .
- ^ E. Bünning, I. Moser: Valinomycins indflydelse på cirkadiske blybevægelser af Phaseolus. I: Proc. Natl. Acad. Sci. USA . 69, nr. 9, 1972, s. 2733, PMC 427027 (fri fuld tekst).
- ↑ W. Engelmann: Lithium bremser uret Kalanchoe. I: Journal of Nature Research B . 27, 1972, s. 477 ( online ). PMID 4403319 .
- ↑ Forståelse af hallucinogener. (Ikke længere tilgængelig online.) Ruprecht-Karls-Universität Heidelberg, arkiveret fra originalen den 17. januar 2012 ; adgang til den 11. juni 2016 .
- ^ Sean MJ McBride et al.: Farmakologisk og genetisk tilbageførsel af aldersafhængige kognitive mangler, der kan henføres til nedsat presenilinfunktion. I: Journal of Neuroscience . 30, 28, 2010, s. 9510-9522, doi: 10.1523 / JNEUROSCI.1017-10.2010 .
- ↑ Lars Vedel Kessing, Thomas Alexander Gerds, Nikoline Nygård Knudsen, Lisbeth Flindt Jørgensen, Søren Munch Kristiansen, Denitza Voutchkova, Vibeke Ernstsen, Jörg Schullehner, Birgitte Hansen, Per Kragh Andersen, Annette Kjær Ersbøll: Association of the Lithium in Drinking Incidence of . I: JAMA Psykiatri . tape 74 , nej. 10 , 2017, ISSN 2168-622X , s. 1005 , doi : 10.1001 / jamapsychiatry.2017.2362 .
- ^ Yumiko Motoi, Kohei Shimada, Koichi Ishiguro, Nobutaka Hattori: Lithium and Autophagy . I: ACS Chemical Neuroscience . tape 5 , nej. 6 , 2014, s. 434-442 , doi : 10.1021 / cn500056q , PMID 24738557 .
- ↑ Kim Zarse, Takeshi Terao, Jing Tian, Noboru Iwata, Nobuyoshi Ishii & Michael Ristow: Lav-dosis lithium optagelsen fremmer levetiden hos mennesker og metazoans. I: Eur J Nutr . 50 (5), 2011, s. 387-389; doi: 10.1007 / s00394-011-0171-x ; PMID 21301855 ; PMC 3151375 (gratis fuld tekst).
- ↑ Takeshi Terao: Er lithium potentielt et sporstof? I: World Journal of Psychiatry . tape 5 , nej. 1 , 2015, s. 1-3 , doi : 10.5498 / wjp.v5.i1.1 .
- ↑ Otto-Albrecht Neumüller (red.): Römpps Chemie-Lexikon. Bind 3: H-L. 8. reviderede og udvidede udgave. Franckh'sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7 , s. 2386-2387.
- ↑ Periodisk system: Lithium . Uniterra.de.
- ^ PJ Pearce, DH Richards, NF Scilly: Et et-trins alternativ til Grignard-reaktionen. I: J. Chem. Soc., Perkin Trans.1 . 1972, s. 1655-1660, doi: 10.1039 / P19720001655 .







![{\ displaystyle \ mathrm {Li ^ { +} + \ mathrm {e} ^ {-} \ {\ xrightarrow [{Electrolysis}] {(450-500) \, ^ {\ circ} C}} \ Li}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/467e9c877afa1b2a38b28c0a03a93ff0beb790c8)