Spektral linje
Som spektrale linjer eller resonanslinjer , skarpt adskilte linjer i et spektrum af udsendte ( emissionslinjer ) eller absorberede ( absorptionslinjer ) af elektromagnetiske bølger i snævrere forstand inden for bølgelængdeområdet for synligt lys ( lysspektrum ). Spektrallinjer er kendetegnet ved bølgelængde , linjeintensitet og linjebredde . Årsagen til de spektrale linjer er de lys-ophidsede elektroniske overgange iAtomer eller molekyler .
Navnet spektral linje går historisk tilbage til det faktum, at der er en indgangsslids i konventionelle spektrometre , hvis form reflekteres på skærmen eller i betragterens øje. Navnet blev senere også overført til toppe (dvs. maxima) i et spektrum registreret som en intensitetskurve.
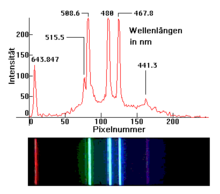
Spektrallinjer forekommer i instrumental atomspektroskopi (såsom nuklear magnetisk resonansspektroskopi ) eller i flammefarvning . De bruges blandt andet i astronomi til at analysere den molekylære struktur af stjerner , planeter og interstellar materie , hvilket ellers ville være umuligt. De befandt sig i lysbrydning fra solen gennem et prisme, der blev opdaget i det 19. århundrede, hvorfra der derefter blev udviklet spektroskoper , der tillod et bredt anvendelsesområde til spektralanalyse .
Grundlæggende
En spektral linje er lyset fra en nøjagtigt defineret frekvens , der udsendes (udsendes) eller absorberes (absorberes) af et atom eller molekyle på grund af en overgang fra et energiniveau til et andet. Frekvensen bestemmes af energien i den udsendte eller absorberede foton ; dette er lig med forskellen mellem energierne i de to kvantemekaniske tilstande . Frekvensen er karakteristisk for denne særlige overgang i den givne type atom. Derfor kan man skelne mellem atomtyper ved at observere spektrale linjer.
Emissionslinje
En emissionslinje vises som en lyslinje i spektret. Det opstår under overgangen fra et højere til et lavere energiniveau , for eksempel når en elektron passerer fra en ophidset tilstand til jordtilstanden . Her udsendes en foton. Dette kan enten ske spontant ( spontan emission ) eller som f.eks. B. med laser exciteres af lys med en passende frekvens ( stimuleret emission ).
Absorptionsledning
Når lys bestråles med et kontinuerligt spektrum (dvs. en frekvensblanding), resulterer resonansabsorption af fotoner med en passende frekvens i en absorptionslinje, hvor en overgang fra et lavere til et højere energiniveau induceres - for eksempel når en elektron passerer gennem fotonet fra valensbåndet ind i ledningsbåndet "løftes" (se fotoelektrisk effekt ).
Når man falder tilbage til det lavere energiniveau, bliver fotoner isotrope , dvs. H. i enhver retning, udsendt.
Begge disse fører til, at lyset spredes diffust af materialet, der bestråles ved denne frekvens . Så længe der er nok absorberende atomer, kommer det til
- en mørk linje i det kontinuerlige spektrum af lys, der skinner igennem ( Fraunhofer-linjen ); dette menes normalt med udtrykket absorptionslinje
- en lys linje mod en mørk baggrund ved analyse af det spredte lys, der kommer ud fra siden af gassen; denne type lysledning kaldes ikke en emissionslinje på grund af historisk terminologi ; Linjer omtales kun som sådan, hvis exciteringen ikke blev foretaget med lys med samme frekvens .
Emissionsprofiler
Lyset fra en spektral linje indeholder ikke en enkelt, skarpt defineret frekvens, men omfatter et (smalt) frekvensområde. Den halve bredde af dette område kaldes for liniebredden . Linjebredden på en emissionslinje består af flere bidrag:
- Lorentz profil
- Den naturlige stregbredde er resultatet af den oprindelige tilstands levetid gennem Heisenberg usikkerhedsprincippet . Dette har form af en Lorentz-kurve . Det er ikke muligt at reducere dette.
- Gaussisk profil
- Atomernes termiske bevægelse skaber en dopplereffekt, der skifter lyset fra et individuelt atom eller molekyle til rødt eller blåt afhængigt af bevægelsesretningen. Den statistiske bevægelse resulterer i en bredere frekvensfordeling samlet. Denne effekt kaldes Doppler-udvidelse . Det har form af en Gaussisk kurve og er afhængig af temperaturen . Normalt dominerer dopplerbredden klart over den naturlige linjebredde. Mekanismen er også kendt under betegnelsen inhomogen linjeudvidelse .
- Voigt-profil
- Under en måling ser det ud til, at en Lorentz-kurve med begrænset bredde har ændret sig fra sin kendte form, hvis apparatets funktion af måleindretningen har en halv bredde i størrelsesordenen af Lorentz-kurven under overvejelse. Linjeformen kan derefter beskrives ved sammenfald af Lorentz-kurven og apparatets funktion. Hvis apparatets funktion er en Gaussisk kurve, kaldes resultatet af sammenfaldet en Voigt-profil .
historie
Absorptionslinjer blev først opdaget i 1802 af William Hyde Wollaston og i 1814 uafhængigt af ham af Joseph von Fraunhofer i solens spektrum . Disse mørke linjer i solspektret kaldes også Fraunhofer-linjer .
De spektrale linjer, blandt andre effekter, bidrog til udviklingen af kvantemekanik . Ifølge klassisk elektrodynamik kunne en elektron bundet i et atom udsende elektromagnetiske bølger af enhver frekvens; eksistensen af diskrete linjer kunne ikke forklares klassisk. Opdagelsen af, at frekvenserne af hydrogenatomets spektrale linjer er proportionale med et udtryk for formen med heltal og førte til begrebet kvantetal og endelig bragte Niels Bohr til sin Bohr-model af atomet , den første - nu forældede - kvantemekanisk atommodel. Moderne kvantemekanik kan forudsige atomernes spektrale linjer med en meget høj grad af nøjagtighed.
litteratur
- Heinz Haferkorn : Optik. Fysisk-tekniske grundlæggende anvendelser. 4. udgave, Wiley-VCH 2003, ISBN 3-527-40372-8
- Ingolf Volker Hertel , Claus-Peter Schulz: Atomer, molekyler og optisk fysik 1 . Springer 2008, ISBN 978-3-540-30617-7
- Peter M. Skrabal: Spectroscopy , vdf Verlag, 2009, ISBN 978-3-8252-8355-1




