sølv
| ejendomme | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Navn , symbol , atomnummer | Sølv, Ag, 47 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Element kategori | Overgangsmetaller | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe , periode , blok | 11 , 5 , d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Udseende | blank hvid, metallisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS -nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EF -nummer | 231-131-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.301 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC -kode | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefraktion af jordens kuvert | 0,079 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 107.8682 (2) et al | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (beregnet) | 160 (165) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 145.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 172 kl | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [ Kr ] 4d 10 5 s 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ioniseringsenergi | 7..576 234 (25) eV ≈ 731 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ioniseringsenergi | 21.4844 (9) eV ≈ 2 072.93 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ioniseringsenergi | 34.8 (3) eV ≈ 3 358 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ioniseringsenergi | 49.0 (1,7 eV) ≈ 4 728 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ioniseringsenergi | 65.0 (1,9) eV ≈ 6 272 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysisk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysisk tilstand | fast | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | Kubisk område-centreret | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| massefylde | 10,49 g / cm³ (20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hårdhed | 2,5 til 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetisme | diamagnetisk ( Χ m = −2,4 10 −5 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 1234,93 K (961,78 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kogepunkt | 2483 K (2210 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molær volumen | 10,27 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 254 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusionsvarme | 11,3 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighed | 2600 m s −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifik varmekapacitet | 235 (25 ° C, konstant tryk) J kg −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arbejdsfunktion | 4,26 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk ledningsevne | 61,35 · 10 6 A · V −1 · m −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | 430 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemisk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstilstande | +1 , +2, +3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalt potentiale | 0,7991 V (Ag + + e - → Ag) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1,93 ( Pauling skala ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For andre isotoper se liste over isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sikkerhedsinstruktioner | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,1 mg m −3 (målt som inhalerbart støv ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toksikologiske data | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Så vidt muligt og sædvanligt anvendes SI -enheder . Medmindre andet er angivet, gælder de givne data for standardbetingelser . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sølv (også latin argentum i apotek ) er et kemisk element med elementets symbol Ag og atomnummer 47. Det er et af overgangsmetallerne . I det periodiske system er det i 5. periode og 1. undergruppe (gruppe 11) eller kobbergruppe. Elementsymbolet Ag stammer fra det latinske ord a r g entum for "sølv" fra. Sølv er et af ædle metaller .
Det er et blødt, let deformerbart ( duktilt ) tungmetal med den højeste elektriske ledningsevne for alle elementer i umodificeret tilstand (kulstof i form af grafen har en anden højere ledningsevne) og den højeste varmeledningsevne for alle metaller . Kun superfluider og uforstyrrede krystallinske former for kulstof ( diamant , grafen og grafit tæt på grafit , kulnanorør ) og bornitrid har bedre varmeledningsevne.
etymologi
Ordet "sølv" ( gammelhøjtysk silabar, silbar og lignende former) stammer fra den almindelige germanske rod * silubra- , ligesom navnene på andre germanske sprog (f.eks. Engelsk sølv ). Den baskiske har taget den germanske ord: zilar . Der er beslægtede navne på de baltiske sprog ( litauiske sidabras ) og de slaviske sprog ( russisk серебро serebro , kroatisk srebro ).
Den filologi af det 19. århundrede bragte en række forskellige teorier ud på ordet oprindelse. Forbindelsen etableret af Victor Hehn i 1870 med det legendariske land Alybē ( Ἀλύβη ) beskrevet i Homers Iliaden må forblive spekulationer. Ordet kunne komme fra et orientalsk sprog, afledt af den semitiske rod SRP (se. Akkadisk Sarapu , forfine ' , legering').
I andre indoeuropæiske sprog går ordet for sølv tilbage til roden * arg , såsom ἄργυρος argyros på oldgræsk og argentum på latin . Argentina blev opkaldt efter det sølv, europæerne håbede at finde der; det er det eneste land opkaldt efter et kemisk grundstof. Det er mere almindeligt at navngive et element efter et land, f.eks. B. Francium , Germanium og Polonium .
historie
Sølv er blevet brugt af mennesker siden omkring det 5. årtusinde f.Kr. Chr behandlet. Det blev f.eks. Brugt af assyrerne , goterne , grækerne , romerne , egypterne og teutonerne . Til tider blev det betragtet som mere værdifuldt end guld . Det meste af sølvet kom fra miner i Laurion , cirka 50 kilometer syd for Athen . Sølv var kendt for de gamle egyptere som månemetal. Også i alkymi står månen ( Luna på latin ) for sølv. Sent middelalderlige og tidlige moderne forfattere, især inden for alkymi, antog, at sølv blev dannet ved at blande svovl og kviksølv (latin: Argentum vivum ). I medicin blev poleret guld blandt andet brugt som medicin mod epilepsi.
I middelalderen og den tidlige moderne periode blev der fundet sølvmalmaflejringer i Centraleuropa i Harzen ( Goslar ), i Waldeck-Frankenberg ( Frankenberg , Goddelsheim , Dorfitter , Thalitter ), på Donnersberg ( Imsbach ), i Thüringen Skov ( Ohrdruf ), i Sachsen ( Freiberg og andre steder Malmbjerge , især Jáchymov ), opdaget i den sydlige Schwarzwald ( Schauinsland , Belchen , Münstertal , Feldberg ), Bøhmen ( Kutná Hora ) og Slovakiet . Rigelige sølvforekomster kendes også fra Kongsberg (Norge).
Den største sølvproducent i middelalderen var Schwaz . En stor del af sølvet på det tidspunkt kom fra tunnelerne af Schwazer -minearbejderne .
Senere bragte spanierne store mængder sølv fra Latinamerika , herunder fra den legendariske Potosí -mine , til Europa. Japan var også en sølveksportør i 1500 -tallet. På grund af det øgede udbud faldt værdien af sølv i den gamle verden.
Da guld hovedsageligt blev brugt som valutametal efter 1870, mistede sølv mere og mere sin økonomiske betydning. Værdi -forholdet faldt fra 1:14 til 1: 100 for et stykke tid, senere steg det lidt igen. I marts 2018 var det omkring 1:81. Tilførslen af sølv afhænger af udviklingen i forbrug og produktion af andre metaller.
I midten af 1800-tallet blev der udviklet rustfrit stål, der på grund af sin brugervenlighed og attraktive pris slog igennem i sølvapplikationer efter Første Verdenskrig , såsom fade, bestik, lysestager og køkkenredskaber. I den modsatte retning udviklede fotografiet og fotokemien sig med sølvsalte bredt i det 20. århundrede, men har siden slutningen af 1990'erne mistet meget af sin betydning i løbet af overgangen til digital billedteknologi.
Den største sølvspekulation anses for at være boblen på sølvmarkedet fra midten af 1970’erne til 1980, som især er forbundet med brødrene Nelson Bunker Hunt og William Herbert Hunt, sølvspekulationerne fra Hunt-brødrene .
Sølv som mineral og sorter
Sølv har en andel på omkring 0,079 ppm i jordskorpen . Det er omkring 20 gange mere almindeligt end guld og omkring 700 gange mindre almindeligt end kobber . I naturen forekommer det værdigt , det vil sige elementært; mest i form af korn, mere sjældent af større nuggets , tynde plader og plader eller som et wiry, forgrenet net ( dendrit ) eller som tynde sølvtråde i hydrotermisk dannede malmårer og i området ved cementeringszonen .
Naturlige forekomster af indfødt sølv var kendt allerede før International Mineralogical Association (IMA) blev grundlagt. Sølv anerkendes derfor som et såkaldt bedstefarvet mineral som en uafhængig type mineral.
Ifølge systematikken for mineraler ifølge Strunz (9. udgave) er sølv klassificeret under systemnr. "1.AA.05" (elementer - metaller og intermetalliske forbindelser - kobberkupalitfamilie - kobbergruppe) eller i den forældede 8. udgave klassificeret under I / A.01 (kobberserie). Systematikken for mineraler ifølge Dana , der hovedsageligt bruges i engelsktalende lande , viser elementet mineral under systemnr. "01.01.01.02" (guldgruppe).
Ud over massivt sølv, hvoraf mere end 5500 steder er blevet dokumenteret hidtil (fra 2018), findes det hovedsageligt i sulfidiske mineraler. De vigtigste sulfidiske sølvmalme omfatter acanthit ( sølvglans ) Ag 2 S med et sølvindhold på omkring 87% og stromeyerit ( kobbersølvglans ) CuAgS med omkring 53% sølv. Mineralet med det højeste sølvindhold på maksimalt 99% er imidlertid det sjældent forekommende allargentum . Også sjældent forekommende sølvmineraler omfatter Chlorargyrite (forældet Hornerz eller Silberhornerz ) AgCl og Miargyrit ( Silver stibnite ) AgSbS 2 . I alt 167 sølvmineraler inklusive naturligt sølv er kendt til dato (fra 2018).
Udover disse sølvmalme kan der også findes såkaldte sølvholdige malme, som normalt kun indeholder små mængder sølv (0,01–1%). Disse er ofte galena (PbS) og chalcopyrite (CuFeS 2 ). Af denne grund ekstraheres sølv ofte som et biprodukt i bly- eller kobberproduktion.
En end Kongsbergit betegnet sølvamalgam med et kviksølvindhold på ca. 5% bruges som en sort, der tilskrives sølvet. Indtil videre er Kongsbergit kendt fra lidt mere end 30 lokaliteter.
Som Arquerit er en Silbervarietät (er sølvamalgam ) udpeget med et kviksølvindhold på 10 til 15%.
Chilenite er en sølvholdig vismut .
En sølvvariant med et indhold på mellem 10 og 30% guld er kendt som Küstelite og er hidtil (fra 2011) blevet påvist på omkring 60 steder.
Det har været kendt siden 1700 -tallet, at kunstigt ( menneskeskabte ) producerede sølvtråde, mest i form af sølvkrøller , kan skabes ved opvarmning af acanthit eller ved smeltning af sølvmalm . Især i de sidste årtier har der været gentagne rapporter i speciallitteraturen om kunstig produktion af sølvkrøller på acanthitniveauer.
Forekomst og ekstraktion
De vigtigste sølvforekomster er i Nordamerika ( Mexico , USA og Canada ) og i Sydamerika ( Peru , Bolivia ). Med knap 20% af den globale produktion var Peru verdens største sølvproducent fra 2003 til 2009 og blev overhalet af Mexico i 2010. I 2017 producerede Mexico mest sølv på verdensplan med 6110 t, efterfulgt af Peru med 4300 t.
Det meste sølv udvindes fra sølvmalm, som ofte findes sammen med bly, kobber og zinkmalm som sulfider eller oxider . Vigtige steder af sølv i værdig form var: Freiberg i Erzgebirge ; Schwaz (Tyrol) ; Kongsberg / Norge (der også store krystaller); Sankt Andreasberg i Harzen; Keweenaw Peninsula / USA (der med også indfødt kobber som "halvras"); Batopilas / Mexico; Mansfeld kobberskiferdistrikt ( Eisleben , Sangerhausen ; for det meste sølvplader; bruges også som fossilt materiale til fossiler).
Mellem begyndelsen af det 20. århundrede og slutningen af anden verdenskrig svingede mængden af sølv, der udvindes årligt, men i gennemsnit forblev det konstant. Fra krigens slutning til i dag er den mere end fordoblet.
Det polske firma KGHM er det vigtigste sølvfirma i EU og det tredjestørste i verden med i gennemsnit 1.200 tons årlig produktion .
Ifølge en undersøgelse foretaget af Rhine-Westphalian Institute for Economic Research , Fraunhofer Institute for Systems and Innovation Research og Federal Institute for Geosciences and Raw Materials er sølvressourcernes globale rækkevidde kun 29 år. Der må derfor forventes mangel på sølv i de næste årtier. Imidlertid genbruges mere og mere sølv også , hvilket beskytter de kendte aflejringer. Baseret på data fra US Geological Survey fra januar 2019 har sølv et statisk område på 21 år i forhold til 2017 .
Som med andre ædle metaller spiller oparbejdning af sølvholdige materialer en vigtig rolle i genanvendelse , f.eks. Fotopapir , røntgenfilm , udvikler- og fikseringsbade, elektronisk skrot og batterier .
| rang | Land | Leveringspriser (i t ) |
rang | Land | Leveringspriser (i t ) |
|
|---|---|---|---|---|---|---|
| 1 |
|
6110 | 7. |
|
1200 | |
| 2 |
|
4300 | 8. |
|
1120 | |
| 3 |
|
3500 | 9 |
|
1030 | |
| 4. |
|
1290 | 10 |
|
1020 | |
| 5 |
|
1260 | hvile | 4770 | ||
| 6. |
|
1240 | i alt | 26800 | ||
Udtræk og præsentation
Ekstraktion fra sølvmalm
20% af sølvet er ekstraheret fra sølvmalm. Sølvet ekstraheres sædvanligvis fra disse ved cyanidudvaskning ved hjælp af en 0,1% natriumcyanidopløsning . For at gøre dette formales malmen først fint til et slam . Natriumcyanidopløsningen tilsættes derefter. God ventilation er vigtig, fordi processen kræver ilt .
Med tilsætning af natriumcyanid går både elementært sølv og sølvmalm (Ag 2 S, AgCl) som dicyanoargentat (I) [Ag (CN) 2 ] - i opløsning:
- ,
- ,
- .
Da reaktionen mellem natriumcyanid og sølvsulfid er i ligevægt, skal natriumsulfidet fjernes enten ved oxidation med oxygen eller ved udfældning (f.eks. Som bly -sulfid). Derefter udfældes det ædlere sølv med zink - svarende til guldminedrift :
- .
Det udfældede råsølv ( fabrikssølv ) filtreres fra og renses yderligere (se raffinering ).
Ekstraktion fra blymalm
Ved ekstraktion af blymalme, f.eks. B. fra bly glans , efter ristning og reducere den såkaldte rå bly eller arbejde bly (mere detaljerede oplysninger om bly ekstraktion i artiklen bly ). Dette indeholder normalt stadig en andel sølv (mellem 0,01 og 1%). I det næste trin fjernes det ædle metal, og dette værdifulde biprodukt opnås.
For at opnå det skal sølvet først skilles fra det meste af blyet. Dette gøres ved hjælp af Parkesierens -processen (efter Alexander Parkes , der opfandt denne proces i 1842). Processen er baseret på den forskellige opløselighed af sølv og bly i zink . Ved temperaturer op til 400 ° C er bly (væske) og zink (fast stof) praktisk talt ublandbart. Først tilsættes zink til det smeltede bly ved temperaturer> 400 ° C. Blandingen afkøles derefter. Da sølv let er opløseligt i smeltet zink, ændres det til zinkfasen. Zinksmelten derefter størkner som et såkaldt zink skum (zink-sølv blandede krystaller). Dette gør det muligt at adskille sølvet fra det meste af blyet. Dette zinkskum er også kendt som arm bly . Det opvarmes derefter til blyets smeltepunkt (327 ° C), så en del af blyet smelter og kan fjernes. Den resterende zink-bly-sølvsmelte opvarmes derefter til kogepunktet for zink (908 ° C), og zink destilleres fra. Produktet opnået på denne måde kaldes rig bly og indeholder omkring 8–12% sølv.
For at berige sølvet udføres nu det såkaldte tvangsarbejde ( raffinering ). Til dette er det rige bly i en ildovn smeltet. En luftstrøm ledes derefter gennem smelten. Blyet oxiderer til blyoxid , mens det ædle sølv forbliver uændret. Blyoxidet udledes løbende, og blyet fjernes gradvist. Hvis blyindholdet i raffinatet er faldet så langt, at der ikke længere dannes et mat blyoxidlag på overfladen af det smeltede metal, åbnes det sidste tynde lag af oxid, og det skinnende sølv nedenunder bliver synligt, dette kaldes sølvet se . Den derefter tilgængelige legering kaldes Blicksilber og består af over 95% sølv.
Ekstraktion fra kobbermalm
Sølv findes også i kobbermalm . Under kobberproduktion opnås sølvet - sammen med andre ædle metaller - i det, der kaldes anodeslam . Dette frigøres først fra størstedelen af det resterende kobber med svovlsyre og luft. Det smeltes derefter på en oxiderende måde i ovnen, hvorved de indeholdte basismetaller går ind i slaggen og kan fjernes.
Raffinering
Rå sølv rengøres elektrolytisk ved hjælp af Moebius -processen . Til dette formål er råsølvet forbundet som en anode til en elektrolysecelle. Et fint sølvark fungerer som katoden og salpetersyre sølvnitratopløsning som elektrolyt .
Processen svarer til elektrolytisk rensning af kobber. Under elektrolysen oxideres sølv og alle de mindre ædle komponenter i råsølvet (f.eks. Kobber eller bly) og går i opløsning. Mere ædle dele som guld og platin kan ikke oxideres og falde ind under elektroden. Der danner de anodeslam, som er en vigtig kilde til guld og andre ædle metaller . Kun sølv er nu deponeret på katoden. Dette meget rene sølv kaldes elektrolyt eller fint sølv.
ejendomme
Fysiske egenskaber
Sølv er et skinnende hvidt ædelmetal . Metallet krystalliserer i det ansigtscentrerede kubiske krystal system . Under normalt tryk er smeltetemperaturen 961 ° C, og kogetemperaturen er 2212 ° C. Sølv har imidlertid allerede et betydeligt damptryk over 700 ° C, dvs. stadig i fast tilstand . Det koger med dannelsen af en enkeltatom, blå damp. Ædelmetallet har en densitet på 10,49 g / cm³ (ved 20 ° C) og tilhører derfor tungmetalerne som alle ædle metaller.
Sølv har en metallisk glans. Friske, ikke -korroderede (skårne) overflader af sølv viser de højeste lysrefleksionsegenskaber for alle metaller, frisk afsat sølv reflekterer over 99,5% af det synlige lys. Som den "hvideste" af alle brugsmetaller bruges den derfor også til fremstilling af spejle. Farven på striben er en gråhvid. Når kornstørrelsen falder, bliver farven mørkere og, i tilfælde af fotografisk fint fordelt sølvkrystaller, sort. Den refleksionsspektrum viser en udtalt plasma kant i nær UV .
Af alle metaller er sølv den bedste leder af varme og elektricitet . På grund af sin elasticitet og blødhed ( Mohs hårdhed på 2,5–4) kan den hamres i de fineste, blågrønne flimrende folier ( sølvblad ) med en tykkelse på kun 0,002 til 0,003 mm eller tynd, med en længde på kun 2 km 0,1 til 1 Træk vejetrådene ud (filigran wire).
I smeltet tilstand opløses rent sølv let 20 gange mængden af ilt fra luften, som slipper ud igen, når smelten størkner og den allerede størknede overflade brister ( revner ). Selv letlegeret sølv viser ikke denne ejendom.
Kemiske egenskaber

Sølv er et ædle metal med et normalt potentiale på +0.7991 V. Af denne grund er det relativt inert. Det reagerer ikke med iltet i luften, selv ved højere temperaturer. Da luften indeholder spor af hydrogensulfid H 2 S, bliver sølvoverflader sorte med tiden, da elementært sølv danner sølvsulfid (Ag 2 S) med hydrogensulfid i nærvær af atmosfærisk ilt :
- .
Sølv opløses kun i oxiderende syrer, såsom salpetersyre . Det er ikke opløseligt i ikke-oxiderende syrer. I nærvær af ilt opløses det også i cyanidopløsninger gennem dannelsen af et meget stabilt sølvcyanidkompleks, som i høj grad forskyder det elektrokemiske potentiale. I koncentreret svovlsyre og salpetersyre opløses sølv kun ved forhøjede temperaturer, fordi det passiveres af sølvnitrat og sulfat . Sølv er stabilt over for smeltede alkalihydroxider, såsom natriumhydroxid . I laboratoriet bruges derfor sølvdigler i stedet for porcelæn eller platindigler til disse smelter.
Biologisk-medicinske egenskaber
I fint opdelt form har sølv en bakteriedræbende virkning, dvs. let giftig , hvilket skyldes det store reaktive overfladeareal på grund af tilstrækkelig dannelse af opløselige sølvioner. I den levende organisme binder sølvioner imidlertid normalt hurtigt til svovl og elimineres fra materialecyklussen som mørkt, dårligt opløseligt sølvsulfid . Effekten afhænger af overfladen. Dette bruges i medicin til sårforbindelser såvel som til invasive anordninger (f.eks. Endotrachealrør). Som regel bruges sølv derfor til bakteriedræbende formål i medicinske produkter som belægning eller i kolloid form, og i stigende grad også nanosølv. Sølvioner bruges som desinfektionsmidler og som terapeutiske midler i sårbehandling. De kan reversibelt hæmme sølvfølsomme patogener efter en relativt lang eksponeringstid og kan også have en bakteriostatisk eller endda bakteriedræbende (dvs. dræbende) effekt. Man taler her om den oligodynamiske effekt. I nogle tilfælde tilsættes chlorforbindelser for at øge sølvets lave effektivitet.
Der anvendes forskellige virkningsmekanismer:
- Blokerer enzymer og forhindrer deres vitale transportfunktioner i cellen,
- Forringelse af cellestrukturens styrke,
- Skader på membranstrukturen.
De beskrevne virkninger kan føre til celledød.
Ud over argyria kan en irreversibel skifergrå misfarvning af hud og slimhinder, øget ophobning af sølv i kroppen også føre til smags- og lugtforstyrrelser samt cerebrale anfald . Sølv akkumuleres i huden, leveren , nyrerne , øjets hornhinde , i tandkødet , i slimhinderne , neglene og milten .
Den terapeutiske anvendelse af kolloidt sølv er kontroversiel , som er kommet tilbage i offentligheden i en årrække og markedsføres via internettet og andre kanaler. Det udråbes primært som et universelt antibiotikum og siges at være i stand til at helbrede andre lidelser. Der er ingen videnskabelige undersøgelser af effektiviteten. Allerede sammenlignelig med en standard antibiotisk effekt er ved peroral stærkt at stille spørgsmålstegn ved administration. Ifølge det amerikanske miljøbeskyttelsesagentur EPA bør meget små oralt indtagne mængder på op til 5 mikrogram sølv pr. Kilogram kropsvægt og dag ikke føre til forgiftning.
I 2014 blev sølv inkluderet i EU's igangværende handlingsplan ( CoRAP ) i overensstemmelse med forordning (EF) nr. 1907/2006 (REACH) som en del af stofvurderingen . Virkningerne af stof på menneskers sundhed og miljøet er re-evalueres og, hvis der indledes nødvendigt opfølgende tiltag. Sølvoptagelse blev drevet af bekymringer om høj (aggregeret) tonnage, andre farerelaterede bekymringer og udbredt brug. Revurderingen fandt sted fra 2014 og blev udført af Holland . En slutrapport blev derefter offentliggjort.
Mytologiske egenskaber
I mange eventyr og sagn betragtes sølv som det eneste metal, der er i stand til at dræbe varulve og andre mytologiske væsener, hvilket også ofte optages i moderne fantasyromaner og film.
brug
Sølv pris
Sølvprisen bestemmes på det åbne marked. Dette er sket på London Bullion Market siden 1600 -tallet . Indførelsen af sølvfiksering i London i 1897 markerede begyndelsen på markedsstrukturen. I 1987 blev London Bullion Market Association (LBMA) stiftet. Tre LBMA -medlemmer deltager i sølvfiksering hver arbejdsdag under ledelse af ScotiaMocatta . Andre medlemmer af sølvfiksering er Deutsche Bank AG London og HSBC Bank USA NA London Branch.
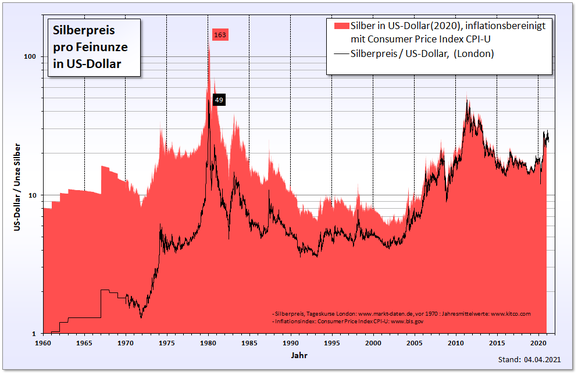
I 1970’erne, hvilket førte sølvspekulationer om brødrene Hunt til et rekordniveau i sølvprisen . Sammen med velhavende forretningsfolk fra Saudi -Arabien købte de enorme mængder sølv og sølvkontrakter på råvareterminsbørser og forsøgte at dominere sølvmarkedet. Den 18. januar 1980 nåede sølvfiksering på London Bullion Market rekordhøjt på 49,45 amerikanske dollars per troy ounce . Sølvprisen nåede sin næste rekord mere end 31 år senere, den 25. april 2011, hvor troy ounce sølv blev handlet til 49,80 amerikanske dollars i Hong Kong. Ifølge det amerikanske arbejdsministeriums inflationsberegner var $ 49,45 i 1980 $ 134,99 i 2011. Det vil derfor vare lang tid, før 1980 -prisen overskrides, under hensyntagen til inflationen.
Til standardiseret sølvhandel på råvarebørser blev "XAG" tildelt som en separat valutakode i henhold til ISO 4217 . Det angiver prisen på en troy ounce sølv (31,1 gram).
Valuta og investering
Den vigtigste anvendelse tidligere var fremstilling af sølvmønter som betalingsmiddel. I oldtiden og i middelalderen blev kun sølv, guld og kobber eller bronze brugt til mønter . Møntværdien svarede stort set til metalværdien ( Kurant -mønt ). I Tyskland var 1871 sølvmønter ( taler udbredt), valutaen var dækket af sølv ( Silver Standard ). Efter 1871 blev sølvstandarden erstattet af guldstandarden . Årsagen til brugen af disse ædle metaller var den høje værdibevarelse (sjældenhed) og stabile værdi af sølv og guld. Kun i moderne tid er mønter fremstillet af andre metaller, såsom jern, nikkel eller zink, men deres metal er lavere og ikke svarer til den værdi, trykt på dem (afdelt mønt ). Som et møntmetal bruges sølv for det meste kun til investeringer , mindesmærker og specielle mønter.
Især i tider med økonomiske kriser - som f.eks B. fra 2007 - ud over guld har ædle metalsølv etableret sig som en af de vigtigste former for investering i forskellige former på grund af dets pris- og værdistabilitet. B. sølvbarrer, sølvsmykker eller sølvmønter. I forbindelse med valutakriser har der siden oldtiden været et sølvforbud flere gange i historien (se guldforbud ).
Økonomi og sport
Ud over guld og ædelsten (f.eks. Diamanter ) er sølv et vigtigt materiale til fremstilling af smykker og har været brugt i århundreder til udsøgte og værdifulde bestik ( bordsølv ) og hellige redskaber . Sølvstempler (skabermærke, bymærke, skattemærke og andre kendetegn) giver oplysninger om varens oprindelse. For smykker, værktøjer og stænger kan sølvindholdet, hvis det er angivet, aflæses fra finhedsmærket .
Sølvmedaljer uddeles i mange sportskonkurrencer, f.eks. B. ved de olympiske lege , uddelt som tegn på at opnå andenpladsen. Den olympiske guldmedalje består også af 92,5% sølv og er kun forgyldt med 6 g rent guld. Præmier omtales også ofte som "sølv" på andre områder. Eksempler er Silver Bear , Silver Stylus , Silver Shoe og Silver Bay Leaf .
Det er også meget populært blandt musikinstrumenter , fordi dets tæthed giver det en dejlig, varm tone, er let at arbejde med B. udskiftede det følsomme træ i fløjten .
Sølv har den højeste elektriske ledningsevne af alle metaller, en høj varmeledningsevne og en udtalt optisk refleksivitet . Dette gør den ideel til applikationer inden for el , elektronik og optik . Glasspejles refleksivitet er baseret på den kemiske sølvbelægning af glasruder. Dette princip bruges også til fremstilling af juletræspynt, optik og lys- eller varmereflektorer. En suspension af sølvpulver i klæbemidler gør dem til elektrisk (og termisk) ledende klæbemidler.
Sølvdannelsen af sølvhalogeniderne som følge af deres henfald gennem lys og udvikling bruges i fotopapir . Det dannede grundlaget for fotografering fra omkring 1850 til spredningen af digital teknologi .
Sølv legeringer (med kobber , zink , tin , nikkel , indium etc.) anvendes i elektroteknik og lodning teknologi som loddelegeringer (såkaldte hårde lodning ), materialer i berøring (f.eks i relæer) og ledende materiale (fx som kondensator foringer ). Sølvlegeringer bruges også i tandteknologi og i dekorationssektoren.
Sølvfade og redskaber afgiver altid noget sølv til mad og drikke, når de bruges, hvilket kan være mærkbart i en ubehagelig metalsmag, især med nogle drikkevarer (vin). For at undgå dette er sølvdrikkekar ofte forgyldt på indersiden. Sølv plettet af sølvsulfid er enten poleret eller kemisk reduceret (se sølvpleje ).
Sølv i medicinske og medicinsk-relaterede applikationer
Materialer eller belægningsprocesser anvender den antibakterielle virkning af sølv i medicinske produkter og andre anvendelser i form af sølvbelægninger, som kolloidt sølv , nanosølv eller i form af sølvtråde. Eksempler inden for medicinsk udstyr:
- Sårforbindelser med kolloidt sølv eller nanosølv
- Sølvbelægninger på endoskopiske rør
- Sølvbelægning af endoproteser
- Plast med sølvdoping til brug i medicinsk teknologi
- Sølvholdige cremer som medicin og kosmetik, f.eks. B. med skæl med mistanke om svampehud eller med neurodermatitis
- Sølvplade som knogleerstatning, typisk kranieknogler, for eksempel med Lex Barker efter en alvorlig hovedskade i 1944. I Münchhausens rejse til Rusland og Skt. Petersborg (fra 1739) i 1786 var der en historie om en hårdtdrikkende general, der "Tog samtidig en sølvplade fast på hans hat, der tjente ham i stedet for kraniet."
Eksempler på hygiejne og andre anvendelser
- Sølvtråde eller sølvioner i tekstilernes antimikrobielle finish hæmmer bakterievækst på huden og forhindrer dermed ubehagelig lugt.
- Belægning af overflader, f.eks. B. i køleskabe, på køkkenmøbler, lyskontakter og andre genstande
- Antibakterielle emaljer og keramik
- Sølvbelagte vandfilterpatroner
- Keramisk kondensator overtræk for elektroteknik / elektronik
Med hensyn til ikke-medicinsk brug af sølv anbefaler Federal Institute for Risk Assessment (BfR) foreløbig generelt at opgive brugen af nanoskala eller nanoskala sølvforbindelser i forbrugerprodukter.
Sølv i katalyse
Sølvkatalysatorer anvendes industrielt til delvis oxidation af ethen til ethylenoxid eller methanol til formaldehyd. På grund af sølvets betydning for oxidationskatalyse er der blevet udført adskillige undersøgelser af interaktionen mellem sølvoverflader og ilt. Forskellige iltarter er lokaliseret på sølvoverfladen, i næroverfladearealet og i sølvmængden. Ud over arter, der overføres til substratet og mere eller mindre selektivt fører til oxidation af et molekyle, er der også centre, der muliggør katalytisk dehydrogenering. Dette er interessant i forbindelse med, at den delvise oxidation af methanol til formaldehyd kræver sub-støkiometriske mængder ilt. Dannelsen af iltarten afhænger af temperaturen, men også af typen af reaktionsatmosfære. Visse O -arter kan ikke påvises ex situ og stiller høje krav til de anvendte karakteriseringsmetoder.
På den anden side katalyserer sølv også reduktionen af organiske substrater med hydrogen, f.eks. B. hydrogeneringen af α, β-umættede carbonylforbindelser. Interaktionen af H 2 med sølvkatalysatorer er - sammenlignet med klassiske hydrogeneringskatalysatorer såsom platin - kun svage. Ag-katalysatorer er derfor i stand til selektivt at hydrogenere dobbeltbindinger af bi- / multifunktionelle molekyler (f.eks. Hydrogenering af acrolein til allylalkohol).
Ikke-metalliske og ikke-bakteriedræbende sølvapplikationer
Som et madfarvestof E 174 bruges sølv også i fødevaresektoren, f.eks. Til belægninger på konfekture såsom praliner og likører . Sølvsalte bliver glas og emalje gule.
Sølvlegeringer
Sølv kan legeres med mange metaller. Det kan legeres godt med guld, kobber eller palladium (et palladiumindhold på 20 til 30 procent gør sølvet blødt modstandsdygtigt ). I begrænset omfang kan sølv legeres med chrom , mangan eller nikkel. Legering øger normalt sølvets hårdhed. Det kan ikke legeres med kobolt eller jern .
De vigtigste sølvlegeringer i dag er kobber- sølvlegeringer. De er som regel udpeget i henhold til deres sølv indhold , udtrykt i tusindedele. De mest almindelige sølvlegeringer har en finhed på 800, 835, 925 og 935 promille sølv. 925 sølv omtales som sterling sølv efter den britiske valuta pund sterling . Det betragtes som den vigtigste sølvlegering og bruges bl.a. bruges til at lave mønter, smykker og bestik.
Med hensyn til eksporten i dag er korpusvarer primært fremstillet af en sølvlegering med en finhed på 935/1000, da varerne med sølvloddet loddes , er deres finhed lavere for i sidste ende at tilfredsstille den lovmæssigt krævede totale renhed i eksempel 925/1000. En ny legering fra England er Argentium ™ sterling sølv, som ikke bør blive tilsmudset . Selv med stærkt brugt bestik har tendensen mod sterlingsølv været i gang i årevis. Sølvvarer er normalt fint forsølvet, mens bestik og slidgenstande er hårdt forsølvet. Den rene sølvbelægning opnår den lyse hvide sølvfarve, der fremmer salget og i høj grad reducerer farvning af varerne.
En sølvlegering, der blev brugt i middelalderen til at dekorere kunstværker, er tula -sølv , en legering af sølv, kobber, bly og svovl. Sølv er også ofte forgyldt ; det kaldes derefter "Vermeil" med et ord, der stammer fra fransk eller latin.
links
Sølv forekommer i kemiske forbindelser hovedsageligt i oxidationstilstanden + I før oxidationstilstandene + II + III + IV og er sjældne og normalt kun i stabile komplekser .
Oxider
- Sølv (I) oxid Ag 2 O er et mørkebrunt fast stof , der opnås fra sølvholdige opløsninger med baser , f.eks B. natriumhydroxid , mislykkes. Ved højere temperaturer , Ag 2 O bryder ned i elementerne .
De sølvoxider med sølv i oxidationstrin større end + jeg kun kan produceres elektrokemisk . Disse er forbindelserne sølv (I, III) oxid AgO, sølv (II, III) oxid Ag 3 O 4 og sølv (III) oxid Ag 2 O 3 .
Halider
Sølvhalogeniderne er blandt de vigtigste sølvforbindelser. De nedbrydes i lys og bruges derfor i analog fotografering . Sølvhalogenider er undtagen fluorid vanskeligt i opløselig vand og anvendes til påvisning af halogenid - ion .
- Sølv (I) fluorid AgF er farveløst og det eneste sølvhalogenid, der er letopløseligt i vand. I modsætning til de andre sølvhalogenider er den ikke lysfølsom .
- Sølv (I) chlorid AgCl er et hvidt, krystallinsk, vanduopløseligt pulver. Det fungerer som bevis for kloridioner . Det bruges også i referenceelektroder og til analog fotografering .
- Sølv (I) bromid er lysegult og også uopløseligt i vand. Da det er mere lysfølsomt end sølvchlorid, bruges det meget ofte som et lysfølsomt lag i analog fotografering.
- Ligesom sølvbromid er sølv (I) iodid gult og uopløseligt i vand. Det bruges også sjældent i analog fotografering. Nogle gange sprøjtes sølviodid fra flyvemaskiner som en kondensationskerne for at danne regn.
- Sølv (II) fluorid AgF 2 er et af de få ikke-komplekse divalente sølvsalte . Det bruges som et fluoriseringsmiddel i stedet for elementært fluor .
Flere forbindelser
- Sølv (I) sulfid Ag 2 S er det sværeste af alle sølvsalte at være opløseligt i vand . Den er sort og fremstilles direkte fra grundstofferne eller ved tilsætning af sølvholdig opløsning med hydrogensulfid . Når sølvbestik pletter, består den mørke belægning også af sølvsulfid.
- Sølvnitrat AgNO 3 er den vigtigste sølvforbindelse og råmateriale til fremstilling af de fleste andre sølvforbindelser. Det er let opløseligt i vand og fremstilles ved at opløse sølv i salpetersyre .
- Sølvsulfat Ag 2 SO 4 dannes, når sølv opløses i koncentreret svovlsyre .
- Sølv azid AgN 3 og sølv acetylid Ag 2 C 2 er højeksplosive. Førstnævnte kan tjene som en udløser for sprængstof . Det meget eksplosive sølv fulminat AgCNO er også kendt som crack -sølv.
- Sølvcyanid AgCN er en meget giftig, farveløst pulver, som bundfald når cyanidioner tilsættes sølv saltopløsninger.
Sølv i højere oxidationstilstande forekommer f.eks. I tetrapyridinosølv (II) persulfat - [Ag (C 5 H 5 N) 4 ] S 2 O 8 , i kaliumtetrafluoroargentat (III) K [AgF 4 ] eller cæsiumhexafluoroargentat (IV ) Cs 2 [AgF 6 ] den. De giftige sølvcyanider er blandt andre. Anvendes i galvaniske bade til sølvbelægning og farvebelægning (lysegul-grønlig-gul). For sølv (I) er tendensen til at danne komplekse ioner udtalt, normalt med koordinationsnummer 2. Med undtagelse af [AgCl 2 ] , som kun dannes i stærkt saltsyreopløsning, er disse komplekse ioner kun stabile i alkalisk eller neutral opløsning .
bevis
Når halogenidopløsning tilsættes dråbevist til den væske, der skal testes, dannes der bundfald i nærvær af sølvkationer, f.eks. B.:
- Ag + (aq) + Cl - (aq) → AgCl (s)
Saltsyre eller natriumchloridopløsning tilsættes derfor som en påvisningsreaktion for sølvsalte. Der dannes et hvidt bundfald af sølvchlorid, der er opløseligt i fortyndet ammoniakvand og danner sølvdiamminkomplekset [Ag (NH 3 ) 2 ] + . Ved høje koncentrationer af chlorid opløses sølvchloridet delvist igen, da komplekse dichloroargentater (I) dannes:
- AgCl + Cl - → [AgCl 2 ] -
Bundfaldet er gulgrønt med iodidioner ( AgI ) og uopløseligt i ammoniakvand, med chlorid- og bromidioner ( AgCl , AgBr ) hvidlige.
heraldik
I heraldik omtales sølv, ligesom guld , som et metal, der er en af de heraldiske tinkturer. Det er ofte repræsenteret af hvid maling.
Se også
litteratur
- AF Holleman , E. Wiberg , N. Wiberg : Lærebog i uorganisk kemi . 102. udgave. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1452-1466.
- Günter Ludwig, Günter Wermusch : Sølv. Fra historien om et ædle metaller. Verlag Die Wirtschaft, Berlin 1986, ISBN 3-349-00101-7 .
Weblinks
- Mineralatlas - sølv (billeder, forekomster, tekniske fakta) , mineralsk portræt sølv
Individuelle beviser
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Lærebog i uorganisk kemi . 102. udgave. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1433.
- ↑ Værdierne for ejendommene (infoboks) er lavet af sølv , medmindre andet er angivet . taget fra : webelements.com .
- ↑ CIAAW, standardatomvægte revideret 2013 .
- ↑ a b c d e post on silver in Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Udg .: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Hentet 11. juni 2020.
- ↑ a b c d e Entry on silver at WebElements, https://www.webelements.com , accessed on June 11, 2020.
- ^ NN Greenwood, A. Earnshaw: Elementernes kemi. 1. udgave. VCH, Weinheim 1988, ISBN 3-527-26169-9 , s. 1509.
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129 til E-145. Værdier der er baseret på g / mol og angivet i cgs -enheder. Den her angivne værdi er SI -værdien beregnet ud fra den uden måleenhed.
- ^ A b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Korrigerede værdier for kogepunkter og entalpier ved fordampning af elementer i håndbøger. I: Journal of Chemical & Engineering Data . 56, 2011, s. 328-337, doi: 10.1021 / je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lærebog i eksperimentel fysik. Bind 6: faste stoffer. 2. udgave. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , s. 361.
- ↑ a b c d e Post på sølv i GESTIS -stofdatabasen i IFA , adgang den 13. april 2020. (JavaScript kræves)
- ↑ Datablad Sølv, pulver, 5-8 μm fra Sigma-Aldrich , åbnet den 25. juni 2020 ( PDF ).
- ↑ Swiss Accident Insurance Fund (Suva): Grænseværdier-aktuelle MAK- og BAT-værdier (søg efter 7440-22-4 eller sølv ), åbnet den 25. november 2019.
- ^ Varmeledningsevne. på webstedet for det tekniske fakultet ved University of Kiel.
- ↑ a b Se sølv i den tyske ordbog for brødrene Grimm.
- ↑ Se Online Etymology Dictionary om engelsk sølv .
- ↑ Jf. Online Etymology Dictionary om engelsk argent (for sølv som heraldisk farve ).
- ^ AF Holleman , E. Wiberg , N. Wiberg : Lærebog i uorganisk kemi . 102. udgave. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1452-1466.
- ^ Wilhelm Hassenstein, Hermann Virl : Fyrværkeribogen fra 1420. 600 år med tyske pulvervåben og pistolsmedning . Genoptryk af det første tryk fra 1529 med oversættelse til højtysk og forklaringer af Wilhelm Hassenstein. Verlag der Deutsche Technik, München 1941, s. 40.
- ^ Wilhelm Hassenstein, Hermann Virl : Fyrværkeribogen fra 1420. 600 år med tyske pulvervåben og pistolsmedning . Genoptryk af det første tryk fra 1529 med oversættelse til højtysk og forklaringer af Wilhelm Hassenstein. Verlag der Deutsche Technik, München 1941, s. 103.
- ↑ IMA / CNMNC Liste over mineralnavne; Juli 2019 (PDF 1,67 MB; sølv se s. 178).
- ↑ IMA / CNMNC Liste over mineralnavne; 2009 (PDF 1,8 MB, sølv se s. 260).
- ↑ Webmineral - Mineraler Arrangeret efter New Dana -klassifikationen. 01/01/01 Guldgruppe .
- ↑ Mindat - Sølv (engelsk).
- ^ Mineralarter indeholdende sølv (Ag). på: webmineral.com .
- ^ Mindat - Kongsbergite .
- ↑ a b Stefan Weiß: Den store Lapis -mineralkatalog. Alle mineraler fra A - Z og deres egenskaber . 6., fuldstændig revideret og suppleret udgave. Weise, München 2014, ISBN 978-3-921656-80-8 .
- ↑ Mindat - Coastal Elite .
- ↑ Mineralienatlas : Antropogene sølvkrøller
- ↑ S. Jahn: Krøllet sølv fra Imiter - ægte eller falsk? I: Min. Verden . Nummer 6, 2008, s. 28–31.
- ↑ USA's geologiske undersøgelse: sølvstatistik og information
- ↑ a b c USA's geologiske undersøgelse: Verdensmineproduktion og reserver januar 2019
- ↑ Tendenser i udbud og efterspørgsel situationen for mineralske råvarer. (PDF; 2,1 MB), Rheinisch-Westfälisches Institut für Wirtschaftsforschung (RWI Essen), Fraunhofer Institute for Systems and Innovation Research (ISI), Federal Institute for Geosciences and Natural Resources (BGR).
- ↑ Jörg Mildenberger: Anton Trutmanns Pharmacopoeia Part II: Dictionary, Volume V. Würzburg 1997, ISBN 3-8260-1398-0 , s. 2274.
- ^ Plasthistorie - Alexander Parkes. på: plasticker.de
- ^ Uorganisk eksperimentelt foredrag: Silber s. 9, Elektrolytisk finrensning (Möbius -proces). ( MS Word ; 1,1 MB).
- ^ Ludwig Hartmann: Faraday til Liebig (1858): Til historien om sølvspejlproduktionen. I: Sudhoffs arkiv. 32, 1939/40, s. 397-398.
- ^ Et sølvovertrukket rør reducerer risikoen for lungebetændelse. I: aerzteblatt.de . 20. august 2008, arkiveret fra originalen den 26. december 2014 ; Hentet 26. december 2014 .
- ^ JR Morones-Ramirez, JA Winkler et al: Sølv forbedrer antibiotisk aktivitet mod gram-negative bakterier. I: Science translationel medicin . Bind 5, nummer 190, juni 2013, s. 190ra81, doi: 10.1126 / scitranslmed.3006276 . PMID 23785037 .
- ↑ M. Glehr, A. Leithner, J. Friesenbichler, W. Goessler, A. Avian, D. Andreou, W. Maurer-Ertl, R. Windhager, P.-U. Tunn: Argyria efter brug af sølvbelagte megaproteser. I: The Bone and Joint Journal . Bind 95-B, udgave 7, juli 2013, s. 988-992.
- ↑ Sølv (CASRN 7440-22-4). på webstedet for American Environmental Protection Agency (EPA).
- ↑ Det Europæiske Kemikalieagentur (ECHA): Konklusion og evalueringsrapport for substansevaluering .
- ^ Fællesskabets rullende handlingsplan ( CoRAP ) for European Chemicals Agency (ECHA): Sølv , adgang til den 20. maj 2019.
- ^ Robert Jackson: Hekseri og det okkulte. Quintet Publishing, Devizes 1995, s.25.
- ↑ Steffen Uttich: Regelændring midt i spillet. I: FAZ.net . 5. juli 2008, adgang til 26. december 2014 .
- ↑ Inflationsberegner .
- ^ Michael Höfling: Sølvstævne i guldstrømmen. I: welt.de . 14. oktober 2009, adgang til 26. december 2014 .
- ↑ Lex Barkers uofficielle fanside - biografi (åbnet 31. januar 2012).
- ↑ BfR fraråder at bruge nanosølv i mad og dagligvarer , erklæring fra 2009 (PDF -fil; 84 kB), adgang til den 14. februar 2012.
- ^ PA Kilty, WMH Sachtler: Mekanismen for den selektive oxidation af ethylen til ethylenoxid. I: Catalysis -anmeldelser . 10, 1974, s. 1-16; doi: 10.1080 / 01614947408079624
- ^ H. Sperber: Produktion af formaldehyd fra methanol i BASF. I: Chemical Engineer Technology . 41, 1969, s. 962-966; doi: 10.1002 / cite.330411705 .
- ↑ A. Nagy, G. Mestl, T. Rühle, G. Weinberg, R. Schlögl: Den dynamiske omstrukturering af elektrolytisk sølv under formaldehydsyntesereaktionen. I: Journal of Catalysis . 179, 1998, s. 548-559; doi: 10.1006 / jcat.1998.2240 .
- ↑ VI Bukhtiyarov, AI Nizovskii, H. Bluhm, M. Hävecker, E. Kleimenov, A. Knop Gericke, R. Schlögl: Kombineret in situ XPS og PTRMS undersøgelse af ethylen epoxidering løbet sølv. I: Journal of Catalysis. 238, 2006, s. 260-269; doi: 10.1016 / j.jcat.2005.11.043 .
- ↑ A. Knop-Gericke, E. Kleimenov, M. Hävecker, R. Blume, D. Teschner, S. Zafeiratos, R. Schlögl, VI Bukhtiyarov, VV Kaichev, IP Prosvirin, AI Nizovskii, H. Bluhm, A. Barinov , P. Dudin, M. Kiskinova: Kapitel 4 Røntgenfotoelektronspektroskopi til undersøgelse af heterogene katalytiske processer. I: Fremskridt inden for katalyse . 52, 2009, s. 213-272; doi: 10.1016 / S0360-0564 (08) 00004-7 .
- ^ J. Hohmeyer: Karakterisering af sølvkatalysatorer til selektiv hydrogenering ved hjælp af DRIFT -spektroskopi, adsorptionskalorimetri og TAP -reaktor. Afhandling . Fritz Haber Institute Berlin / Technical University Darmstadt, 2009.
- ↑ Indgang på E 174: Sølv i den europæiske database om tilsætningsstoffer til fødevarer, adgang til 16. juni 2020.






![{\ mathrm {2 \ Ag + H_ {2} O + \ ^ {1} / _ {2} \ O_ {2} +4 \ NaCN \ rightarrow \ 2 \ Na [Ag (CN) _ {2}] \ + \ 2 \ NaOH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fba93cd5116a374b26aa38f72742866453ea44dc)
![{\ mathrm {Ag_ {2} S \ +4 \ NaCN \ højrepil \ 2 \ Na [Ag (CN) _ {2}] \ + \ Na_ {2} S}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6bf0f1c4f727b94f22faf612ed38e2cb4885b6f)
![{\ mathrm {AgCl \ +2 \ NaCN \ rightarrow \ Na [Ag (CN) _ {2}] \ + \ NaCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a590c9281279d9c39aa718d4ce1a2e9eef95360)
![{\ mathrm {2 \ Na [Ag (CN) _ {2}] \ + Zn \ højrepil \ Na_ {2} [Zn (CN) _ {4}] + \ 2 \ Ag}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd1b344603946cf96dec47c9df68b469b2610fa0)