Titanium (IV) oxid
| Krystalstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Titanium (IV) oxid i modifikationen rutil __ Ti 4+ __ O 2− | ||||||||||||||||||||||
| Generel | ||||||||||||||||||||||
| Efternavn | Titanium (IV) oxid | |||||||||||||||||||||
| andre navne | ||||||||||||||||||||||
| Forholdsformel | TiO 2 | |||||||||||||||||||||
| Kort beskrivelse |
hvidt, krystallinsk pulver |
|||||||||||||||||||||
| Eksterne identifikatorer / databaser | ||||||||||||||||||||||
| ||||||||||||||||||||||
| ejendomme | ||||||||||||||||||||||
| Molar masse | 79,866 g mol −1 | |||||||||||||||||||||
| Fysisk tilstand |
fast |
|||||||||||||||||||||
| massefylde |
|
|||||||||||||||||||||
| Smeltepunkt |
1855 ° C |
|||||||||||||||||||||
| kogepunkt |
2900 ° C |
|||||||||||||||||||||
| opløselighed | ||||||||||||||||||||||
| Brydningsindeks |
optisk anisotrop , dobbeltbrydende eller tosidig |
|||||||||||||||||||||
| Sikkerhedsinstruktioner | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 3 mg m −3 (målt som åndbart støv ) |
|||||||||||||||||||||
| Toksikologiske data | ||||||||||||||||||||||
| Så vidt muligt og sædvanligt anvendes SI -enheder . Medmindre andet er angivet, gælder de givne data for standardbetingelser . Brydningsindeks: Na-D-linje , 20 ° C | ||||||||||||||||||||||
Titanium (IV) oxid ( titandioxid ) er det IV- værdsatte oxid af titan . Ud over dette polymorfe oxid er der en række ikke-støkiometriske suboxider af titanium, såkaldte Magneli-faser, samt titanium (III) oxid og titanium (II) oxid .
Titandioxid har en bred vifte af anvendelser som et hvidt pigment , hvorfor der hvert år produceres fire til fem millioner tons på verdensplan. De vigtigste anvendelsesområder er inden for belægninger såsom lak og maling efterfulgt af plastfarvning og laminatpapir. Farvede produkter indeholder normalt også hvide pigmenter for at opnå høj skjulekraft .
Brugen af titandioxid som tilsætningsstof til fødevarer er kontroversiel. I maj 2021 erklærede Den Europæiske Fødevaresikkerhedsautoritet (EFSA) brugen af stoffet opført som E 171 som usikkert. Frankrig havde allerede forbudt dets anvendelse i fødevarer i 2020; Schweiz ønsker også at følge trop inden udgangen af 2021.
historie
Efter at William Gregor opdagede titanium i ilmenitten i 1791 , genkendte Heinrich Klaproth titandioxid i rutil . Industriel brug begyndte, da dets fremragende egnethed som et hvidt pigment blev anerkendt i Norge og USA i 1908 . Fra 1916 blev pigmentet produceret kommercielt under navnet Kronos Titan White. Indtil 1938 blev titaniumhvid kun produceret i anatasemodifikationen , men derefter i stigende grad i rutilmodifikationen, da dens fotokatalytiske aktivitet er lavere og forvitringsstabiliteten for de produkter, der er fremstillet deraf, er tilsvarende højere. Det hvide pigment baseret på rutilmodifikationen er også kendt som rutilhvid.
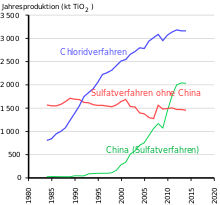
Mere end halvdelen af produktionsmængden bruges i belægninger efterfulgt af polymerer og papir. I 2014 blev 70% af verdens produktion produceret af fem producenter i den vestlige verden. Ud over markedslederen Chemours (USA, tidligere DuPont ) er det virksomhederne Cristal Global (overtaget af Tronox i 2019, Saudi -Arabien), Tronox (USA), Venator Materials (Storbritannien, tidligere en del af Huntsman , USA) og Kronos (USA). Den største producent i Asien er LomonBillions (Folkerepublikken Kina). Ifølge en præsentation fra Venator Materials fra juni 2018 havde de fem største vestlige producenter 54% af den globale produktionskapacitet. De regioner, der forbruger mest titandioxid, er Europa (1,72 millioner t), Folkerepublikken Kina (1,42 millioner t), resten af Asien (1 million t) og Nordamerika (0,89 millioner t)).
Hændelse
Titanium (IV) oxid forekommer naturligt i fire ændringer :
- Rutile er et tetragonal mineral med en for det meste prismatisk vane . Krystalstrukturen er i rumgruppen 136, som svarer til Hermann Mauguin -symbolet P4 2 / mnm. Rutil TiO 2 har en densitet på 4,26 g / cm 3 . Navnet rutil kommer fra det latinske rutilus 'rødlig', hentyder til den producerede farve ved jern urenheder.
- Anatase danner tetragonale holohedrale krystaller (holohedral betyder den mest symmetriske gruppe inden for et krystalsystem ) i den tetragonale således 4 / m 2 / m 2 / m . Det krystalliserer i rumgruppe 141, det vil sige I4 1 / amd. Anatase omdannes irreversibelt til rutil ved 700 ° C afhængigt af atmosfæren og fremmede ioner. Tætheden af anatase er 3,88 g / cm 3 .
- Brookit danner orthorhombiske mineraler og krystalliserer i rumgruppe 61, Pbca. Brookit også ændringer til rutil under smeltepunktet og har en densitet på 4,12 g / cm 3 . Teknisk set har brookitten ingen betydning.
- Riesite ( IMA 2015-110a ) er en højtryksmodifikation, der krystalliserer i det monokliniske krystalsystem i rumgruppe P 2 / c (rumgruppe nr. 13 ) og blev opdaget i 2015 af Oliver Tschauner og Chi Ma i Nördlinger Ries (Bayern, Baden-Württemberg).
Yderligere ændringer
Ud over de naturlige modifikationer kendes otte syntetisk producerede modifikationer, hvoraf tre er metastabile (monokliniske, tetragonale og orthorhombiske) og fem højtryksmodifikationer (α-PbO 2 , baddeleyite, cotunnite og orthorhombiske og kubiske strukturer). Modifikationen med en cotunnitstruktur blev beskrevet af L. Dubrovinsky et al. som det hårdest kendte oxid med en Vickers hårdhed på 38 G Pa og et kompressionsmodul på 431 GPa (til sammenligning: diamant har 442 GPa til 446 GPa) under normalt tryk. Senere undersøgelser kom til forskellige resultater med lavere værdier for hårdheden (7–20 GPa, altså blødere end oxider som korund Al 2 O 3 og rutil) og kompressionsmodulet (≈ 300 GPa).
| modifikation | Krystal system | Fremstilling |
|---|---|---|
| TiO 2 (B) | monoklinisk | Hydrolyse af K 2 Ti 4 O 9 med efterfølgende temperering |
| TiO 2 (H), hollanditlignende strukturform | tetragonal | Oxidation af kaliumtitanat bronze, K 0,25 TiO 2 |
| TiO 2 (R), ramsdellitlignende struktur | orthorhombic | Oxidation af lithium titanat bronze Li 0,5 TiO 2 |
| TiO 2 (II) -( α -PbO 2 -lignende struktur) | orthorhombic | |
| Baddeleyit -lignende struktur, (7 -foldet koordineret Ti) | monoklinisk | |
| TiO 2 -OI | orthorhombic | |
| kubisk struktur | kubisk | P > 40 GPa, T > 1600 ° C |
| TiO 2 -OII, cotunnite ( PbCl 2 ) -lignende struktur | orthorhombic | P > 40 GPa, T > 700 ° C |
Udtræk og præsentation
Titandioxid kan være i laboratoriet ved hydrolyse af Ti (IV) forbindelser såsom titanylsulfat , titantetrachlorid som metalalkoholater eller titantetraisopropylat fremstilles:
- Reaktion af titaniumoxidsulfat med vand til dannelse af titaniumoxohydrat og svovlsyre
- Omsætning af titantetrachlorid med vand i det første trin til titanium oxychlorid og saltsyre og derefter til titan oxohydrate og saltsyre
- Titantetraisopropoxid og vand reagerer for at danne titandioxid og isopropanol
Da titansyreesterne i de lavere n -alkanoler reagerer for voldsomt, anbefales brug af isopropanol eller tert -butanolestere. Titan oxohydrate opnås på denne måde, formelt TiO (OH) 2 eller TiO 2 × H 2 O, omdannes til anatase eller rutil ved kalcinering , med ren, stærkt udglødet titandioxid altid producerer rutil gitter. Forbrænding af titanium (IV) chlorid med ilt bruges sjældent i laboratorieskala. Meget rent titandioxid kan fremstilles ved at hydrolysere oprenset TiCU 4 .
Da det meste af det industrielt producerede TiO 2 bruges som pigment, forstyrrer farveioner såsom jern . Ilmenit (FeTiO 3 ) eller titanholdige slagger fra elektroreduktion af ilmenit anvendes generelt som malme til sulfatprocessen . Denne slagge kan, ligesom rutil fra alluviale aflejringer , også bruges i den teknisk mere krævende chloridproces . Begge processer øger titaniumoxidets renhed betydeligt. Summen af farveionerne er normalt mindre end 200 ppm i sulfatprocessen, hovedsageligt niob, underordnet jern og mindre end 50 ppm i chloridprocessen, niob og jern.
I den industrielle fremstilling af titanoxid fra ilmenit hjælp sulfatprocessen, fortyndet syre er (fortyndet svovlsyre) dannet, som for det meste genanvendes efter koncentrering for ilmenit fordøjelse . I nogle lande udledes denne fortyndede syre stadig delvist i floder og hav eller dumpes . I modsætning hertil ekstraktion under anvendelse af chloridprocessen , hovedsagelig fra rutil malm eller TiO 2 slagge, tillader ikke dannelsen af tynde syre. Det anvendte klor forbliver stort set i procescyklussen. De jernsalte, der produceres i begge processer, bruges blandt andet til chromatreduktion i cement, spildevandsrensning og i biogasanlæg.
Enkeltkrystaller
Enkeltkrystaller af rutil fremstilles normalt ved hjælp af Verneuil -processen . Zonsmeltningsprocessen bruges også lejlighedsvis , mens Czochralski -processen beskrives som uegnet.
Anatase -enkeltkrystaller kan ikke dannes fra smelten. Her er CTR brugt metode.
ejendomme
Fysiske egenskaber
Smeltepunktet for titandioxid er 1855 ° C, forbindelsen er termisk stabil. Titandioxid er også kemisk inert . Det er lyshurtigt, billigt og derfor det vigtigste hvide pigment. Det er godkendt som tilsætningsstof E171 til fødevarer.
Optiske egenskaber
Den brydningsindeks af titanoxid er høj, og det viser en stor spredning . Brydningsindekset afhænger også væsentligt af krystalmodifikationen. Titandioxid er dobbeltbrydende . Forskellen i brydningsindekset mellem en almindelig stråle og en ekstraordinær stråle kan nå en værdi på op til .
Fra et koloristisk synspunkt har titandioxid på grund af dets høje brydningsindeks den højeste skjulekraft af alle hvide pigmenter og samtidig en fremragende lysstyrke . Den maksimale dækning af titandioxid er ved en kornstørrelse på ca. 200 nm til 300 nm afhængigt af applikation og reference, nummerbaseret eller massebaseret størrelsesfordeling.
Titandioxid er en halvleder , så valensbåndet er fuldt udfyldt og ledningsbåndet ledigt ved nul temperatur . Den båndgab afhænger af ændringen. Lette kvanta med en energi, der er større end båndgabet, absorberes. UV -lys kan også absorberes fra den passende bølgelængde, hvilket skaber UV -beskyttelse. Kortbølget lysbestråling løfter elektroner fra valensbåndet ind i ledningsbåndet og efterlader et hul . Størrelsen af båndgabet afhænger af krystalretningen og inden for nanopartikulært materiale også af partikelstørrelsen.
| modifikation | Båndgab (eV) | Bølgelængde (nm) | interpoleret brydningsindeks ved 589 nm |
|---|---|---|---|
| Anatase | 3,23 | 385 | n e = 2,489 n o = 2,561 |
| Brookite | 3.14 | 395 | n α = 2,585 n β = 2,583 n γ = 2,702 |
| Rutile | 3.02 | 410 | n e = 2.900 n o = 2.613 |
Dielektriske egenskaber
Titandioxid har en forholdsvis høj dielektrisk konstant . For rutil er det ε = 111 i den krystallografiske a-retning og ε = 257 langs c-aksen. Andre kilder giver mindre værdier, hvorved værdierne afhænger af måleparametre som frekvens og temperatur. Ansøgninger er f.eks. High-k dielektrikum .
Kemiske egenskaber
Af titanoxiderne er titandioxid (IV) den mest almindelige forbindelse. Det er kemisk inert og kan kun opløses i varm svovlsyre, flussyre og varme alkalier. Det er delvist udgangsmaterialet til fremstilling af titanater . Ved belysning med UV -lys kan fotokatalytiske radikalreaktioner finde sted.
brug
Titandioxid bruges hovedsageligt som et hvidt pigment og er angivet i farveindekset under CI Pigment White 6 eller CI 77891. Det er kemisk stabilt og bruges under E 171 -mærket som et tilsætningsstof til fødevarer, f.eks. Som en lysner til tandpasta, tyggegummi, konfekt, ost eller saucer og som adskillelsesmiddel (se afsnit Risici ). Titandioxidpigmenter bruges som CI 77891 i kosmetik. Det bruges også delvist i oliemaleri . De tekniske anvendelsesområder for titandioxid, der tegner sig for omkring 80 procent af det samlede forbrug, omfatter maling og lak , plast og tekstiler; Det bruges også i papirproduktion til at opnå en høj grad af hvidhed og som UV -blokker i solcremer og lysere i lægemidler (tabletter).
pigment
Titandioxid har et brydningsindeks, der er betydeligt højere end for de fleste organiske stoffer, der bruges til at binde farver. Det betyder, at pigmenter fremstillet af titaniumoxid spreder lyset effektivt, hvilket resulterer i en veldækkende hvid farve. Den optimale størrelse af pigmenterne er i området fra 200 nm til 300 nm. Størrelsesområdet er resultatet af Mie -teorien . Partikelstørrelsen påvirker uigennemsigtigheden på den ene side og farvetonen på den anden side; findelte pigmenter fremstår mere blålige. Med en markedsandel på omkring 60% er de vigtigste anvendelser belægningsmaterialer og 25% polymeranvendelser.
Bortset fra E171, er ren titandioxid anvendes sjældent, da de ud over UV beskyttende virkning af TiO 2, lysinducerede kemiske radikale reaktioner finder sted. Funktionalisering af pigmentkornene reducerer denne effekt og forbedrer samtidig farveegenskaberne, normalt gennem lettere spredning. Nogle applikationer, f.eks. B. til fibre eller cementapplikationer, brug anatasepigmenter på trods af den højere fotokemiske aktivitet, mens størstedelen af applikationerne falder tilbage på rutilpigmenter.
Fotokatalysator
Mange producenter tilbyder fotokatalysatorer baseret på TiO 2 . Disse er normalt anatase, anatase-rutilblandinger eller dopede titandioxider med en lang række mulige anvendelser. Fotokatalyse er en heterogen katalyse , hvor gasformige eller opløste stoffer reagerer under UV -belysning ved radikal reaktion eller ladningsbæreroverførsel til titandioxid eller andre stoffer. Ved at belyse med UV -lys, hvis energi er større end båndgabet, eller ved den mindre effektive excitation fra urenheder fra en doping, genereres gratis ladningsbærere, elektroner i ledningsbåndet og huller i valensbåndet . Som regel rekombinerer disse ladningsbærerpar meget hurtigt, men bøjningen af båndet i overfladens område kan resultere i ladningsbærerseparation. Disse reagerer normalt med adsorberet ilt og vand for at danne hydroxyl- og peroxygrupper. Bortset fra direkte ladningsoverførsler til adsorbater reagerer radikaler som regel med adsorberede organiske stoffer. Reaktionsvejene til fuldstændig mineralisering kan være meget komplekse og kræve mange foton excitationer.
Til udendørs brug, fotokatalytisk selvrensning som eksempel, bruges generelt UV-komponenten i sollys ASTM 1.5 på omkring 3%, maksimalt omkring 35 W / m 2 . Indendørs applikationer er normalt mindre gunstige, på den ene side er UV -komponenten meget lav, eller reaktionshastigheden er lav i tilfælde af dopede katalysatorer. Parametrene i fotokatalyse er forskelligt definerede kvanteudbytter . Typiske værdier kan næppe angives, da et stort antal parametre er inkluderet i katalysen. Normalt nævnes størrelsesordener på 1 reaktion pr. 1000 fotoner. Et andet problem er, at de fotokatalytiske reaktioner ikke skelner mellem den organiske bindemiddelmatrix og forurenende stoffer. Uegnede bindemiddelsystemer har derfor en tendens til at kridtes tidligt .
Andre anvendelser
Ved fremstilling af specielle optiske briller bruges TiO 2 til at påvirke den optiske spredning, Abbe -nummeret . Titandioxid i anatasemodifikationen er hovedkomponenten i katalysatorerne, der anvendes til industriel denitrifikation af røggasser ved hjælp af SCR -processen . Farvestoffets solcelle ( Grätzel -celle ) er baseret på halvlederegenskaberne af titandioxid . Ved hjælp af titandioxid blev der lavet memristors . Titandioxid bruges også som hovedkomponent i det keramiske dielektrikum i klasse 1 keramiske kondensatorer . Syntetiske rutile enkeltkrystaller bruges til optiske prismer eller som diamantimitationer på grund af deres optiske egenskaber . Efterligningerne er lette at genkende på grund af dobbeltbrydningen. Derudover bruges titandioxid til fremstilling af testaerosoler .
bevis
Titandioxid, der udfældes i kulden, er amfotert og opløseligt i fortyndede mineralsyrer. En fordøjelse finder sted med kaliumhydrogensulfat i en porcelænsdigel. Derefter opløses det i koldt vand med lidt svovlsyre. Med et par dråber hydrogenperoxid dannes den gule (basiske) til gulorange (sure, foto) [Ti (O 2 ) · aq] 2+ kation.
Dating
I stratigrafiske undersøgelser af 115-årige wiener letbanerækninger malet omkring 15 gange af Otto Wagner , blev det første udseende af rutilhvid brugt til at datere malingslag.
Risici
Titandioxid er ikke klassificeret som farligt for vand .
I juni 2017 vurderede ECHA's Risikovurderingsudvalg (RAC) klassifikationsforslaget fra den franske myndighed, der havde foreslået klassificering og mærkning som "sandsynligvis kræftfremkaldende hos mennesker" (Carc 1B), og kom til den konklusion, at titandioxid blev mistænkt for at være kræftfremkaldende ved indånding skal klassificeres (Carc 2). Dette klassificeringsforslag skulle kontrolleres af Europa -Kommissionen og implementeres i gældende lovgivning.
Meget høje koncentrationer af nanopartikler , dvs. partikler med mindre end 100 nm, fører til immunreaktioner i lungerne . Immunreaktionen diskuteres med mulighed for en inflammation-baserede risiko kræft, med nanopartikulære TiO 2 mindre end 100 nm, der testes og pigmenteret TiO 2 større end 200 nm anvendes som et eksempel ansøgning og til fremstilling mængde.
I en gruppe på 56 personer, der selektivt blev valgt på grund af problemer med titaniumimplantater, viste 21 mennesker en positiv reaktion i MELISA -testen (lymfocyttransformationstest) med TiO 2 , mens alle 54 personer i gruppen testede ved hjælp af patch -testen, testede negativ. En undersøgelse fra University of North Carolina fandt ud af, at titandioxid nanopartikler var giftige for mikrogliale hjerneceller i mus.
I test af biologer ved universitetet i Koblenz-Landau med dafnier (vandlopper) blev der fundet nogle væsentlige virkninger på trods af lave koncentrationer af titandioxid i vandet: De koncentrationer, der blev anvendt i testen, op til 2 mg / l, var op til en faktor på over 1000 over den mistænkte koncentration i miljøet på ng / l til et par µg / l. Den primære effekt var gennem akkumulering af partikler på chitin skallen af vandet lopper med fatale konsekvenser i testgruppen. Den næste generation af dafnier viste også skader i undersøgelserne via en virkningsmekanisme, der ikke blev fortolket og analyseret. Nogle af disse undersøgelser er i direkte modsætning til et ældre studie med betydeligt højere koncentrationer på op til 50 mg / l.
Hos rotter, efter 100 dages oral administration af titandioxid , gav INRA bl.a. Tarmbetændelse noteret. Ifølge forfatterne svarer dosis på 10 mg / kg til den mængde, som mennesker kan blive udsat for ved brug som fødevarefarvestof E171. En anden undersøgelse viser også, at tarmbetændelse kan forværres af E171.
Undersøgelser af cytotoksiciteten af fotokatalytisk aktive titandioxid -nanopartikler har vist: nanopartikler fremstillet af titandioxid kan danne reaktive radikaler, når de absorberer UV -stråling, som er i stand til at nedbryde mange organiske stoffer. Denne ejendom har mange industrielle anvendelser, men den medfører også risiko for skadelige virkninger på levende organismer.
Klassificering som "sandsynligvis kræftfremkaldende ved indånding"
| Sikkerhedsinstruktioner | ||||||||
|---|---|---|---|---|---|---|---|---|
| Efternavn |
Blandinger i form af pulver med et indhold på mindst 1% titandioxid i partikelform eller inkorporeret i partikler med en aerodynamisk diameter på ≤ 10 μm |
|||||||
| CAS -nummer | ||||||||
| EF -nummer |
236-675-5 |
|||||||
| ||||||||
| Toksikologiske data | ||||||||
I 2012 blev titan (IV) oxid inkluderet i EU's igangværende handlingsplan ( CoRAP ) i overensstemmelse med forordning (EF) nr. 1907/2006 (REACH) som en del af stofvurderingen . Virkningerne af stof på menneskers sundhed og miljøet er re-evalueres og, hvis der indledes nødvendigt opfølgende tiltag. Årsagerne til optagelsen af titanium (IV) oxid var bekymringer om andre farerelaterede bekymringer samt de formodede farer ved kræftfremkaldende egenskaber og den mulige fare for mutagene egenskaber. Revurderingen startede i 2018 og blev udført af Frankrig . Efter at titandioxid forårsagede betændelse i dyreforsøg og forskere havde mistanke om kræftfremkaldende egenskaber, besluttede Frankrig i 2019 at forbyde brugen i fødevarer fra 2020.
En potentiel sundhedsfare ses primært ved indånding af støv; dette har været genstand for mange diskussioner. I oktober 2019 besluttede EU -Kommissionen at klassificere og mærke titandioxid i pulverform med mindst 1% partikler med en aerodynamisk diameter ≤ 10 μm som formodentlig kræftfremkaldende for mennesker (kategori 2) ved indånding (H350 i). Den 18. februar 2020 blev den foreslåede klassificering af titandioxid vedtaget som en del af den 14. ATP (tilpasning til den tekniske udvikling) i forordning (EU) nr. 2020/217 og skal derfor implementeres inden den 1. oktober 2021.
Brug som tilsætningsstof til fødevarer
I maj 2021 klassificerede Den Europæiske Fødevaresikkerhedsautoritet (EFSA) farvestoffet som usikkert til konsum, da det ikke kunne udelukke en negativ effekt af titandioxid på det menneskelige genom . I Schweiz, hvor fødevarer indeholdende titandioxid har været nødt til at bære noten nano på ingredienslisten siden 1. maj 2021 , vil E 171 blive forbudt som tilsætningsstof til fødevarer indtil udgangen af 2021, ifølge Federal Food Safety and Veterinary Kontor ; nogle producenter undlader allerede frivilligt det kontroversielle farvestof i visse produkter.
Brug i medicin
Over 30.000 lægemidler indeholder titandioxid. I maj 2021 meddelte EU -Kommissionen , at den ville bede EU Lægemiddelagentur (EMA) om at undersøge, om og hvordan titandioxid kan udskiftes i medicin. Ifølge Federal Institute for Drugs and Medical Devices indeholder næsten en tredjedel af de "faste orale doseringsformer", der er godkendt i Tyskland, titandioxid.
Weblinks
- Zusatzstoffe-online.de: Titandioxid
Individuelle beviser
- ↑ Indgang på E 171: Titandioxid i den europæiske database om tilsætningsstoffer til fødevarer, adgang til 16. juni 2020.
- ↑ Indtastning af TITANIUM DIOXIDE i CosIng -databasen i EU -Kommissionen, adgang til den 5. august 2020.
- ↑ a b c d e f g h i Post på titanium (IV) oxid i GESTIS -stofdatabasen i IFA , adgang til 19. december 2019. (JavaScript kræves)
- ↑ a b Indgang på titandioxid. I: Römpp Online . Georg Thieme Verlag, adgang 1. juni 2014.
- ↑ a b T. Radhakrishnan: De optiske egenskaber ved titandioxid . I: Afvikling af indiske Academy of Sciences - Afsnit A . tape 35 , nej. 3 , 1952, s. 117-125 , doi : 10.1007 / BF03172227 .
- ↑ Swiss Accident Insurance Fund (Suva): Grænseværdier-aktuelle MAK- og BAT-værdier (søg efter 13463-67-7 eller titandioxid ), adgang til den 2. november 2015.
- ↑ Univ. Freiburg foredrag script kemi, oxider del 4: Ikke-støkiometriske binære oxider.
- ↑ United States Geological Survey USGS TITANIUM MINERAL CONCENTRATES (engelsk PDF; 27 kB).
- ↑ a b EFSA: Titandioxid: E171 betragtes ikke længere som sikkert, når det bruges som tilsætningsstof til fødevarer. 6. maj 2021, adgang til 11. maj 2021 .
- ↑ a b Peter Fritsche: Kontroversiel whitener - Schweiz forbyder også titandioxid i fødevarer. Schweizisk radio og fjernsyn (SRF), 11. maj 2021, adgang 11. maj 2021 .
- ↑ T. Brock, M. Groteklaes, P. Mischke; Maleteknologi lærebog; 2. udgave; Vincentz netværk; Hannover; 2000; ISBN 3-87870-569-7 ; S. 123.
- ↑ https://www.icis.com/explore/resources/news/2018/07/19/10243097/tio2-players-in-major-asset-shuffle/
- ↑ Chemours: TiO2 Market Forbrug (s. 9), de vigtigste konkurrenter og teknologi (s. 13) , September 2015 (data status 2014)
- ↑ en b c Krystalstruktur database Center for Computational Materials Science ( Memento af den originale fra april 11, 2011 i den Internet Archive ) Info: Den arkiv link blev indsat automatisk, og er endnu ikke blevet kontrolleret. Kontroller venligst det originale og arkivlink i henhold til instruktionerne, og fjern derefter denne meddelelse. fra US Naval Research Laboratory .
- ↑ U. Hålenius, F. Hatert, M. Pasero, SJ Mills: IMA Commission on New Minerals, Nomenclature and Classification (CNMNC). Nyhedsbrev 35 . I: Mineralogisk magasin . tape 81 , nej. 1 , februar 2017, s. 209–213 ( main.jp [PDF; 79 kB ; adgang til den 19. august 2017]).
- ↑ a b LS Dubrovinsky, NA Dubrovinskaia, V Swamy, J Muscat, NM Harrison, R Ahuja, B Holm, B Johansson: Materialevidenskab: Det hårdest kendte oxid . I: Naturen . 410, nr. 6829, 2001, s. 653-654. doi : 10.1038 / 35070650 . PMID 11287944 .
- ↑ Oganov AR, Lyakhov AO: På vej mod teorien om hårdheden af materialer . I: J. af Superhard Materials . 32, nr. 3, 2010, s. 143-147. doi : 10.3103 / S1063457610030019 .
- ↑ Y. Al-Khatatbeh, KKM Lee og B. Kiefer: Højtryks-adfærd TiO 2 som bestemt af eksperiment og teori . I: Fys. Rev. B . 79, nr. 13, 2009, s. 134114. doi : 10.1103 / PhysRevB.79.134114 .
- ↑ Nishio-Hamane D., Shimizu A., Nakahira R., Niwa K., Sano-Furukawa A., Okada T., Yagi T., Kikegawa T:. Stabiliteten og tilstandsligningen for cotunnite fase af TiO 2 op til 70 GPa . I: Fys. Kem. Mineraler . 37, nr. 3, 2010, s. 129-136. doi : 10.1007 / s00269-009-0316-0 .
- ↑ Marchand R., L. Brohan, Tournoux M.: En ny form for titandioxid og kaliumocktatitanat K 2 Ti 8 O 17 . I: Materialeforskningsbulletin . 15, nr. 8, 1980, s. 1129-1133. doi : 10.1016 / 0025-5408 (80) 90076-8 .
- ↑ M. Latroche, L. Brohan, R. Marchand, M. Tournoux: Nye hollandite oxider: TiO 2 (H) og K 0,06 TiO 2 . I: Journal of Solid State Chemistry . 81, nr. 1, 1989, s. 78-82. doi : 10.1016 / 0022-4596 (89) 90204-1 .
- ↑ J. Akimoto, Y. Gotoh, Y. Oosawa, N. Nonose, T. Kumagai, K. Aoki, H. Takei: Topotaktisk oxidation af Ramsdellite-type Li 0,5 TiO 2 , en ny polymorf af titandioxid: TiO 2 ( R) . I: Journal of Solid State Chemistry . 113, nr. 1, 1994, s. 27-36. doi : 10.1006 / jssc.1994.1337 .
- ↑ PY Simons, F. Dachille: Strukturen af TiO 2 II, en højtryksfase af TiO 2 . I: Acta Crystallographica . 23, nr. 2, 1967, s. 334-336. doi : 10.1107 / S0365110X67002713 .
- ^ Sato H., Endo S, Sugiyama M, Kikegawa T, Shimomura O, Kusaba K: Baddeleyite-type højtryksfase af TiO 2 . I: Videnskab . 251, nr. 4995, 1991, s. 786-788. doi : 10.1126 / science.251.4995.786 . PMID 17775458 .
- ↑ Dubrovinskaia NA, Dubrovinsky L S., Ahuja R, Prokopenko V B., Dmitriev V., Weber H.-P., Osorio-Guillen JM, Johansson B: Eksperimentel og teoretisk identifikation af en ny højtryks-TiO 2- polymorf . I: Fys. Lett. . 87, nr. 27 Pt 1, 2001, s. 275501. doi : 10.1103 / PhysRevLett.87.275501 . PMID 11800890 .
- ^ Mattesini M, de Almeida JS, Dubrovinsky L., Dubrovinskaia L, Johansson B., Ahuja R.: Højtryks- og højtemperatur-syntese af den kubiske TiO 2- polymorf . I: Fys. Rev. B . 70, nr. 21, 2004, s. 212101. doi : 10.1103 / PhysRevB.70.212101 .
- ↑ a b c Georg Brauer (red.): Håndbog i forberedende uorganisk kemi . 3., omarbejdet. Udgave. tape II . Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s. 1366 .
- ↑ C. Murty, R. Upadhyay, S. Asokan: Eletro Smeltning af Ilmenite til produktion af TiO 2 Slag. (PDF; 715 kB).
- ↑ Djeva virksomhedsbrochure om avl ved hjælp af Verneuil -metoden (tysk, 4,2 MB PDF).
- ^ Kazuhito Hatta, Mikio Higuchi, Junichi Takahashi, Kohei Kodaira, "Floating zone growth and characterization of aluminium-doped rutile single crystals", Journal of Crystal Growth, 163, 1996, s. 279-284; doi: 10.1016 / 0022-0248 (95) 00972-8 .
- ^ H. Machida og T. Fukuda: "Stødte på vanskeligheder under Czochralski-væksten af TiO 2- enkeltkrystaller", Journal of Crystal Growth, 112, 1991, s. 835-837; doi: 10.1016 / 0022-0248 (91) 90142-R .
- ^ T. Sekiya og S. Kurita, "Defects in Anatase Titanium Dioxide", Nano- and Micromaterials-Advances in Materials Research, 2008, Volume 9, pp. 121–141, doi : 10.1007 / 978-3-540-74557- 0_4 .
- ^ Polymerer, lys og videnskaben i TiO 2 DuPont . (1,42 MB PDF).
- ^ Erik Shepard Thiele: Spredning af elektromagnetisk stråling af komplekse mikrostrukturer i resonansregimet . 1998 ( PDF, 3,2 MB - Ph.d. -afhandling, University of Pennsylvania).
- ↑ J. Winkler: Titandioxid. Vincentz Network, Hannover 2003, ISBN 3-87870-738-X , s. 55.
- ↑ Michael Graetzel, Francois P. Rotzinger: The Influence af krystalgitterstrukturen på Varmeledning Band Energi Oxider af titan (IV) . I: Kemisk fysik bogstaver . Bind 118, nr. 5, 1985, side 474-477.
- ^ Bora Lee, Choong-ki Lee, Cheol Seong Hwang og Seungwu Han: Indflydelse af udvekslingskorrelationsfunktioner på dielektriske egenskaber af rutil TiO 2 , i: Current Applied Physics , bind 11 (2011), S293-S296. doi: 10.1016 / j.cap.2010.11.104 .
- ^ Rebecca A. Parker "Statisk dielektrisk konstant af Rutile (TiO 2 ), 1,6-1060 ° K" , Phys. Rev. 124, 1961, s. 1719-1722.
- ↑ Titandioxid i fødevarer . Titandioxid Manufacturers Association (TDMA), tilgås 11. maj 2021.
- ↑ Ceresana: Titandioxid Market Study , adgang den 21. maj 2013.
- ^ KRONOS Titan: Anvendelsesområder for TiO 2 (PDF; 374 kB).
- ↑ Sachtleben: Hombikat UV 100 .
- ↑ Evonik Aerosil, Aeroxid P25 ( Memento fra 1. juli 2012 på internetarkivet ).
- ↑ KRONOS Titan: Kronoclean -datablad (PDF; 488 kB).
- ^ Neue Zürcher Zeitung: "Brosten mod smog" , oversigtsartikel, 16. november 2011.
- ^ Fraunhofer Photocatalysis Alliance: "Biologiske effektivitetsmålinger for fotokatalysator" (PDF; 79 kB).
- ^ Tusnelda E. Doll: "Fotokemisk og fotokatalytisk nedbrydning af carbamazepin , clofibric , iomeprol og iopromid ", Dissertation, 2004, DNB 1002433525/34 .
- ↑ Martin Lindner: "Optimering af den fotokatalytiske vandrensning med titandioxid: Fotokatalysatorens faste og overfladestruktur", afhandling, DNB 954460030/34 .
- ↑ Center for fornybar ressource: Sunlight Spectrum ASTM 1.5 .
- ^ Thorsten Ebbinghaus: "Kombineret biologisk-fotokatalytisk nedbrydning af miljømæssigt relevante nitrogenforbindelser til rengøring af landbrugsspildevand med tilgroede plantefiltre og TiO 2 / UV" , TU Dortmund, afhandling, 2003 (PDF; 1,5 MB).
- ^ Martin Klare: "Muligheder for fotokatalytisk nedbrydning af miljørelevante nitrogenforbindelser ved hjælp af TiO 2 " , TU Dortmund, afhandling, 2003 (PDF; 3,3 MB).
- ↑ Kevin Bullis: Genopkobling af elektronikken . Teknologigennemgang. 8. maj 2008, adgang til 25. marts 2010.
- ↑ VDI 3491 ark 3: 2018-03 måling af partikler; Fremstillingsproces til testaerosoler; Spredning af bunker og faste stoffer (Måling af partikler; Metoder til frembringelse af testaerosoler; Spredning af faste materialer). Beuth Verlag, Berlin. S. 7.
- ↑ VDI 3491 ark 9: 1989-1909 måling af partikler; Produktion af testaerosoler ved hjælp af en børstedispenser (måling af partikler; generering af testaerosoler med en roterende børstegenerator). Beuth Verlag, Berlin. S. 5.
- ↑ Otto Wagner and the Green of the 50s: Sehgewohnheiten und Reality orf.at, 31. december 2017, tilgået 31. december 2017.
- ↑ ECHA pressemeddelelse af 9. juni 2017
- ↑ nanopartikel.info: Nanocare , brochure, side 11 ff. (Tysk, PDF; 2,7 MB).
- ^ Yazdi, AS; Guarda, G. Riteau, N. Drexler, SK; Tardivel, A.; Couillin, I. Tschopp, J. (2010). Nanopartikler aktiverer NLR-pyrindomænet indeholdende 3 (Nlrp3) inflammasom og forårsager lungebetændelse gennem frigivelse af IL-1 og IL-1 . Proceedings of the National Academy of Sciences 107 (45): s. 19449-19454 doi: 10.1073 / pnas.1008155107 , PMC 2984140 (fri fuld tekst).
- ↑ Biodenth.be (PDF; 245 kB) K. Müller, E. Valentine-Thon: "Overfølsomhed over for titanium: Klinisk og laboratoriebevis" ( erindring af 9. november 2013 i internetarkivet ) Neuroendocrinology Letters, Vol. 27, Suppl 1, 2006, s. 31-35.
- ^ TC Long, N. Saleh, RD Tilton, GV Lowry, B. Veronesi: Titandioxid (P25) producerer reaktive iltarter i udødeliggjort hjernemikroglia (BV2): konsekvenser for nanopartikelneurotoksicitet. I: Miljøvidenskab og teknologi . Bind 40, nummer 14, juli 2006, s. 4346-4352. PMID 16903269 .
- ^ Mirco Bundschuh, Frank Seitz, Ricki R. Rosenfeldt, Ralf Schulz, Elena A. Rozhkova: Titandioxid -nanopartikler øger følsomheden i den næste generation af vandloppen Daphnia magna. I: PLoS ONE. 7, 2012, s. E48956, doi: 10.1371 / journal.pone.0048956 .
- ↑ Volker Mrasek : deutschlandfunk.de: Indflydelse selv på tværs af generationer (22. marts 2014).
- ↑ Nadja Podbregar: Cross generationerne konsekvenser: nano-forurening af små krebsdyr gør deres afkom over-følsomme. I: scinexx.de. 8. marts 2013, adgang til 20. august 2019 .
- ^ Kerstin Hund-Rinke, Markus Simon: Økotoksisk effekt af fotokatalytiske aktive nanopartikler (TiO2) på alger og dafnier Miljøvidenskab og forureningsforskning international: ESPR 13 (2006), nr. 4, s. 225-232, doi: 10.1065 / espr2006.06.311 .
- ^ Bettini, S. et al.: Food-grade TiO2 forringer tarm- og systemisk immunhomeostase, starter preneoplastiske læsioner og fremmer afvigende kryptudvikling i rotttarmen. Scientific Reports 7, Artikelnummer: 40373 (2017), doi: 10.1038 / srep40373 .
- ↑ Titandioxid -nanopartikler kan øge tarmbetændelse
- ↑ doi: 10.1136 / gutjnl-2015-310297
- ↑ C. Kasper, J. Z. Bloh, S. Wagner, D. W. Bahnemann, T. Scheper: Undersøgelser af cytotoksicitet af fotokatalytisk aktive titandioxid -nanopartikler . I: Chemical Engineer Technology. 82, 2010, s. 335, doi: 10.1002 / cite.200900057 .
- ↑ a b Indgang på titanium (IV) oxid i pulverform med mindst 1% partikler med en aerodynamisk diameter ≤ 10 μm i GESTIS -stofdatabasen i IFA , adgang til 19. december 2019. (JavaScript kræves)
- ↑ indtastning på titandioxid i klassificeringer og mærkninger af det Europæiske Kemikalieagentur (ECHA), adgang den 7. januar 2021. Producenter eller forhandlere kan udvide den harmoniserede klassificering og mærkning .
- ^ Fællesskabets rullende handlingsplan ( CoRAP ) for European Chemicals Agency (ECHA): Titandioxid , adgang til den 26. marts 2019.
- ↑ Frankrig forbyder det kontroversielle blegemiddel titandioxid . Spiegel Online, 17. april 2019.
- ↑ Forordning (EU) 2020/217
- ↑ Titandioxid: Der er stadig behov for forskning . Forbundsministeriet for risikovurdering, 29. juli 2020.
- ↑ Fødevaresikkerhed: EU -Kommissionen foreslår et forbud mod godkendelse af titandioxid. I: tid online . 6. maj 2021, adgang til 11. maj 2021 .
- ↑ Titandioxid / Titandioxid / CI 77891 | sandsynligt forbud. I: scriptorium. Hentet den 24. maj 2021 (tysk).
- ^ Forbyde sundhedsfarlige nanopartikler som tilsætningsstoffer til fødevarer. I: parlament.ch . 2019, adgang til 28. januar 2021 .
- ^ Peter Fritsche: Kontroversielt farvestof - titandioxid forsvinder fra flere og flere produkter. Swiss Radio and Television (SRF), 26. april 2021, adgang 26. april 2021 .
- ↑ Jost Maurin / taz.de 30. maj 2021: Usikkert farvestof i tabletter