Radiojodterapi
Den radioaktivt jod terapi (RIT, også radioaktivt iod, RIT) er en nuklearmedicinske terapier til behandling af skjoldbruskkirtlen autonomi , af Graves' sygdom , den udvidelsen skjoldbruskkirtlen og visse former for kræft i skjoldbruskkirtlen . Den radioaktive iod - isotop jod -131 anvendes, hvilket er en overvejende beta emitter med en halveringstid på otte dage og kun lagret i skjoldbruskkirtlen celler i det menneskelige legeme .
Radiojodterapi er underlagt særlige juridiske krav i mange lande og kan kun udføres i Tyskland i en indlæggelse. Terapiformen er blevet brugt siden 1940'erne og anses for at have få bivirkninger og er sikker selv i den langsigtede opfølgning. I Tyskland (fra 2014) er der omkring 120 behandlingsfaciliteter, hvor der årligt udføres omkring 50.000 behandlinger.
Anvendelsesområder og alternativer
De mest almindelige indikationer for radiojodterapi er den autonome dysfunktion i skjoldbruskkirtlen ( autonomt adenom , multifokal autonomi, formidlet autonomi), Graves sygdom (Graves sygdom) og de former for skjoldbruskkirtelkræft (skjoldbruskkirtelcancer), der lagrer jod: papillær og follikulær Skjoldbruskkirtelkræft. Udvidelse af skjoldbruskkirtlen ( struma ) uden dysfunktion behandles også i stigende grad med radiojodterapi.
Graviditet er en absolut kontraindikation til radiojodterapi ved godartede skjoldbruskkirtelsygdomme. Af generelle radiobiologiske overvejelser anbefales det at undgå graviditet i op til 6 måneder efter radiojodbehandling. Hvis der opstår graviditet i løbet af denne periode, er dette ikke en tilstrækkelig grund til abort . Det anbefales dog at søge genetisk rådgivning . Med hensyn til radiojodterapi for skjoldbruskkirtelkræft under graviditet kan den teoretiske sandsynlighed for forekomst af genetisk skade beregnes, men sådan skade er endnu ikke opstået.
Alternative behandlingsmetoder for dysfunktionen er forskellige former for skjoldbruskkirtelkirurgi og i tilfælde af autonome adenomer i visse tilfælde scleroterapi med alkohol . I nogle af tilfældene kan Graves sygdom midlertidigt eller permanent falde i dets aktivitet ( remission ) under lægemiddelbehandling med anti-skjoldbruskkirtlen . Som en afsluttende ("endelig") behandling er kirurgi ud over radiojodterapi også en mulighed . I tilfælde af skjoldbruskkirtelcarcinom kan radiojodterapi kun undlades efter operationen i papillær carcinom i det tidlige stadium pT1a . Lægemiddelterapi , kirurgi og radiojodterapi anvendes til behandling af godartet forstørrelse af skjoldbruskkirtlen .
Når man vælger mellem kirurgi og radiojodterapi, taler følgende argumenter for den ikke-kirurgiske metode: Hvis skjoldbruskkirtlen allerede er blevet opereret, eller hvis der allerede er (ensidig) lammelse af stemmebåndnerven ( tilbagevendende parese ) hos ældre patienter eller med alvorlige ledsagende sygdomme, hvis skjoldbruskkirtlen er relativt lille, eller hvis patienten lider af frygt for operation. Ungdomsalderen betragtes ikke længere som en kontraindikation . Følgende argumenter taler imidlertid for operationen: mistanke om malignitet ( malignitet ), overaktiv skjoldbruskkirtel forårsaget af jod ( hyperthyroidisme ), graviditet og amning , aktiv øjeninddragelse i Graves sygdom ( endokrin orbitopati ), tegn på indsnævring (kompression) af de omkringliggende strukturer ( trachea : stridor , spiserøret : udtalt synkelidelse , hals fartøjer: øvre kapacitetsbegrænsninger ), frygt af stråling eller store, kolde områder af skjoldbruskkirtlen.
Veterinærmedicin
Inden for veterinærmedicin er radiojodterapi den valgte terapimetode til hyperthyroidisme hos katte , men udføres kun i begrænset omfang på grund af de tekniske krav og strålingsbeskyttelseskrav.
Lovkrav
I de fleste lande er implementeringen af radiojodterapi underlagt visse lovbestemte og kvasi-lovbestemte regler. I mange lande kan radiojodterapi udføres poliklinisk (dvs. uden hospitalsindlæggelse).
I Tyskland, det strålingsbeskyttelse Ordinance og ”Radiation Protection in Medicine” guideline udstedt af delstaterne Udvalget for kerneenergi regulerer gennemførelsen af radioaktivt jod terapi. De bestemmer, at behandlingen kun må udføres på en nuklearmedicinsk terapistation. Den læge, der udfører arbejdet, skal have en tilsvarende håndteringstilladelse , hvis tildeling blandt andet er knyttet til " teknisk og ekspertviden inden for brugen af radioaktive stoffer til diagnostik og terapi". Tilstedeværelsen af en medicinsk fysikekspert er nødvendig. Kravene til strålingsbeskyttelse skal tages i betragtning med hensyn til strukturelle og personalemæssige aspekter. Især skal der være et passende henfaldssystem til radioaktivt forurenet spildevand. Tilsynspersonalet skal regelmæssigt instrueres i strålingsbeskyttelse.
Polikliniske terapier er mulige i Østrig . Grænseaktiviteterne er lovbestemt. Tilstedeværelse af en medicinsk fysiker er også påkrævet i Østrig.
I Schweiz kan radiojodterapi med en anvendt aktivitet på op til 200 MBq udføres poliklinisk.
I USA kan radiojodterapi udføres poliklinisk op til en aktivitet på 1110 MBq. Størstedelen af terapierne for godartede skjoldbruskkirtelsygdomme kan udføres poliklinisk.
Terapiprincip og fysiske basics
Den radioaktive iodisotop iod-131 er tilgængelig som natriumiodid i kapselform og i vandig opløsning. Det administreres normalt oralt , men i undtagelsestilfælde (for eksempel i tilfælde af udtalt synkeforstyrrelser) kan det også administreres intravenøst . Når det tages oralt, absorberes jod hurtigt gennem maveslimhinden og frigives i blodet ( resorption ). Jod når skjoldbruskkirtelcellen via natriumiodid-symporteren og lagres i sidste ende i skjoldbruskkirtlen. Under virkningen af TSH- eller TSH-receptorantistoffer øges optagelsen af jod i skjoldbruskkirtlen. Autonome dele af skjoldbruskkirtlen optager iod uafhængigt af TSH.
Den særlige elegance ved radiojodterapi ligger i det faktum, at kun skjoldbruskkirtelceller absorberer jod - og dermed også radiojod - andre organer lagrer ikke jod. Jodet, der ikke opbevares i skjoldbruskkirtlen, fjernes hurtigt fra kroppen via nyrerne og dermed via urinen . Små mængder udskilles af svedkirtlerne og gennem tarmene. En lille mængde jod udskilles af spytkirtlerne og maveslimhinden , men absorberes igen via mave-tarmkanalen. På grund af disse specielle egenskaber ved iodmetabolismen er det muligt at opnå en meget høj strålingsdosis i målvævet ( fokaldosis ), mens de andre væv kun har en lav strålingseksponering .
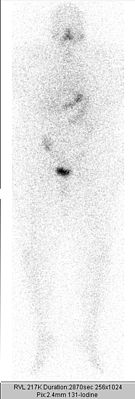
Jod-131 er et nuklid produceret i atomreaktorer og har en halveringstid på 8,02 dage. Når det forfalder til stabilt xenon , frigives en beta-partikel - med en maksimal energi på 0,61 MeV og et gennemsnitligt vævsområde på 0,5 mm. Denne stråling er ansvarlig for den terapeutiske effekt. Derudover frigives gammastråling med hovedtoppen ved 364 keV, som kan forlade skjoldbruskkirtlen og er derfor på den ene side ansvarlig for patientens og miljøets uønskede strålingseksponering , men på den anden side kan den også bruges til billeddannelse og radioiodintesten .
Betastrålerne forårsager skade på DNA'et i nærheden af skjoldbruskkirtelcellerne , især dobbeltstrengede brud, som i sidste ende fører til initiering af programmeret celledød ( apoptose ) (→ virkningsmekanisme ved strålebehandling ).
Radiojodterapi til godartede skjoldbruskkirtelsygdomme
forberedelse
Jod forlader
For at opnå optimal absorption af jod i skjoldbruskkirtlen bør yderligere jodkilder undgås inden radiojodtesten og behandling med radioaktivt jod ( jodafholdenhed ). Sådanne kilder til iod er især iodholdige kontrastmedier , den antiarytmiske amiodaron og visse iodholdige desinfektionsmidler . En ventetid på 6 uger er tilstrækkelig for vandopløselige kontrastmedier. Efter brug af lipidopløselige kontrastmedier eller amiodaron, som også er liposoluble, kan skjoldbruskkirtlen blokeres i mange måneder.
Der findes betydelige mængder iod i mange multivitaminpræparater og kosttilskud såvel som i havfisk, fisk og skaldyr og visse produkter fremstillet af alger. Disse jodkilder bør undgås i ca. en uge før jodtesten og behandlingen. Indtagelse af iod fra iodiseret bordsalt og industrielt fremstillede fødevarer tilberedt med det er praktisk taget umuligt at undgå fuldstændigt.
Metabolisk justering
Om muligt skal radioaktivt iod behandling ikke udføres, hvis metabolisme er åbenbart hyperthyroid , som overaktiv funktion kan forøges ved frigivelsen af thyroidhormoner thyroxin (T 4 ) og triiodthyronin (T 3 ). Derfor normale værdier for T 4 og T 3 bør fastsættes med den lavest mulige dosis af midler med thyreostatisk effekt i ugerne før radioaktivt iod terapi . Imidlertid reducerer anti-skjoldbruskkirtelmedicin optagelsen af jod i skjoldbruskkirtlen, så det anbefales at stoppe med at bruge dem mindst en til to dage før radiojodbehandling.
Med autonomi i skjoldbruskkirtlen bør TSH- værdien undertrykkes så meget som muligt på tidspunktet for radiojodterapi for at minimere jodoptagelse i ikke-autonome dele af skjoldbruskkirtlen via den tyrotrope kontrolsløjfe . Om nødvendigt skal skjoldbruskkirtelhormoner gives i forberedelsesfasen. I tilfælde af euthyroid goiter udføres terapi normalt uden ledsagende skjoldbruskkirtel-styret medicin.
Bestemmelse af den passende behandlingsaktivitet
Den tyske retningslinje "Strålingsbeskyttelse inden for medicin" foreskriver: "Når man planlægger en nuklearmedicinsk behandling, skal dosis for de organer eller væv, der skal behandles [...] bestemmes på forhånd, og den aktivitet, der skal administreres derefter, måles. Hvis der kræves patientspecifikke parametre, skal der anvendes individuelle målinger og data. "
Ved bestemmelse af den aktivitet, der kræves til terapi i Tyskland og Østrig, skal en medicinsk fysiker konsulteres ud over nuklearmedicinsk specialist. Måldosis, målvolumen og integrationen af aktiviteten i skjoldbruskkirtlen over tid er inkluderet i beregningen .
Målvolumenet for radiojodterapi og den energidosis, der sigter mod målvolumenet, afhænger af sygdommen, der skal behandles. Med Graves sygdom, med skjoldbruskkirtelforstørrelse uden autonomi og med formidlet autonomi, tages det sonografisk bestemte samlede volumen af skjoldbruskkirtlen som målvolumen, med unifokal og multifokal autonomi kun volumenet af adenomer. Måldoserne rettet mod i henhold til retningslinjerne fra det tyske selskab for nuklearmedicin til radiojodterapi ved godartede skjoldbruskkirtelsygdomme er angivet i den følgende tabel.
| Måldosis rettet mod radiojodterapi | effektiv halveringstid | ||
|---|---|---|---|
| sygdom | målrettet måldosis | Euthyroidisme | Hyperthyroidisme |
| Unifokal autonomi | ca. 300 til 400 Gy | 4,8 dage | 4,2 dage |
| Multifokal autonomi | omkring 150 Gy | 5,5 dage | 4,8 dage |
| Formidlet autonomi | omkring 150 Gy | 5,5 dage | 4,8 dage |
| Graves sygdom | - | - | 4,2 dage |
| Ablativt koncept | ca. 200 til 300 Gy | - | - |
| Funktionsoptimeret koncept | omkring 150 Gy | - | - |
| Goiter for at reducere størrelsen | ca. 120 til 150 Gy | 5,5 dage | - |
Aktivitetstidsintegralet kan bestemmes med radiojodtesten . Til dette formål administreres en lille mængde radioiodin (normalt oralt ): ca. 1 til 5 MBq iod-131 eller - sjældnere - 5 til 10 MBq iod-123. På bestemte tidspunkter måles aktiviteten over skjoldbruskkirtlen og sammenlignes med den oprindelige aktivitet og dens naturlige henfald. At bestemme den maksimale optagelse ( optagelse ) i procent og den effektive halveringstid i dage. Jo flere målepunkter der er, jo mere præcist kan området under kurven bestemmes. Af praktiske grunde (ambulant) gennemførlighed foretages målinger normalt kun efter 24 og 48 timer og muligvis først efter 24 timer. I Graves sygdom kræves en indledende måling efter fire til otte timer på grund af den accelererede iodmetabolisme. For nøjagtigt at bestemme den effektive halveringstid er en yderligere måling nødvendig efter fire til otte dage. Da der kun er mindre forskelle i den effektive halveringstid mellem de enkelte patienter med den samme sygdom og den samme metaboliske status, kan den effektive halveringstid også antages som en empirisk bestemt værdi (se tabel).
Den terapeutiske aktivitet, der skal anvendes, kan derefter beregnes ved hjælp af Marinelli-formlen (ifølge Leonidas D. Marinelli , 1906–1974, Argonne National Laboratory ).
Her, A er den aktivitet, der skal beregnes, HD er målet dosis , V er det specifikke mål volumen, K er en empirisk bestemt konstant på 24,7, U max er den maksimale optagelse og t 0,5 eff er den effektive halveringstid.
Forbehandling med kortison til endokrin orbitopati
En endokrin ophthalmopati (eo) i Graves sygdom kan blive værre under radiojodterapi eller først optræde. Med allerede eksisterende eO anbefales behandling med glukokortikoider (kortison) fra dagen for radiojodterapi eller dagen før ; doseringen afhænger af sværhedsgraden af øjensygdommen. I Graves sygdom uden endokrin orbitopati er den profylaktiske administration af glukokortikoider kontroversiel. De mulige bivirkninger og kontraindikationer ved kortisonbehandling ( diabetes mellitus , mavesår og elektrolytforstyrrelser ) skal overholdes.
oplysning
Inden du starter radiojodtesten og radiojodterapi, gives en forklaring . I dette informeres patienten om forløbet af testen og terapien samt risiciene og bivirkningerne ved radiojodterapi . I lande, hvor radiojodterapi kun kan udføres på patientbasis, er emnet for den uddannelsesmæssige diskussion, at patienten ikke må forlade behandlingsenheden, efter at terapien er blevet administreret. Patientens opmærksomhed henledes ligeledes på, at regelmæssige opfølgende undersøgelser er lægeligt nødvendige og krævet ved lov (se Opfølgning Care sektionen ).
udførelse
Efter den mest perorale - i undtagelsestilfælde intravenøs - administration af jod-131 skal patienten i Tyskland forblive på terapiafdelingen i mindst 48 timer. Det anbefales at være ædru ca. en time efter oral indtagelse, indtil radiojodet stort set absorberes.
Regelmæssige målinger af strålingen udføres derefter normalt; disse gør det muligt at drage konklusioner om den aktivitet, der er tilbage i hele patientens krop eller i skjoldbruskkirtlen . Den førstnævnte er vigtig for tidspunktet for udskrivning efter terapien , den sidstnævnte for den maksimale værdi og tidsforløbet til overvågning af terapiens succes. Den faktisk opnåede maksimale optagelse (U max ) og den faktisk opnåede effektive halveringstid (t 0,5 eff ) kan bestemmes, og den faktisk opnåede fokusdosis (HD) kan bestemmes ved at ændre Marinelli-formlen (se ovenfor ). Målvolumen V og den empirisk bestemte konstant K er uændrede.
Hvis fokaldosen afviger signifikant opad fra den planlagte værdi, er der en større sandsynlighed for, at en underaktiv skjoldbruskkirtel udvikler sig efter behandlingen, og opfølgning bør planlægges i overensstemmelse hermed.
Hvis fokaldosen på den anden side afviger markant nedad, kan der stadig gives en ekstra dosis radiojod under det indlagte behandlingsophold for stadig at opnå den ønskede måldosis og for at sikre en vellykket behandling. Det skal bemærkes , at optagelsen af den anden dosis regelmæssigt er lavere end den første på grund af den tidlige effekt af radiojodterapi (”bedøvelse”) .
Ved at administrere små mængder ikke-radioaktivt iod eller lithium efter indgivelse af radioiod kan den resterende radioiod i skjoldbruskkirtlen og dermed den effektive halveringstid t 0,5 eff forlænges og en besætningsdosis, der er op til 30% højere, kan opnås . Især med lithium skal der tages hensyn til risici og bivirkninger såvel som det snævre terapeutiske interval .
Risici og bivirkninger
Strålingseksponering
På grund af de biologiske egenskaber ved jod og de fysiske egenskaber ved jod-131 forårsager radiojodterapi kun et lavt niveau af strålingseksponering af de organer, der ikke absorberer radiojod. Den stråling er i de tilstødende skjoldbruskkirtlen strukturer såsom larynx eller parathyroidea lav - på grund af den korte rækkevidde af betastråling fra skjoldbruskkirtlen. Nogle væv, der udtrykker natriumiodid-symporteren , herunder spytkirtler , mave og kvindebryst , akkumuleres midlertidigt jod. Nyrerne , urinblæren og tarmene er involveret i udskillelsen af radiojodfraktionen, der ikke er lagret i skjoldbruskkirtlen. I alle disse væv er der en integritet med lav aktivitetstid, strålingseksponeringen er tilsvarende lav. Med et optagelse af radiojod i skjoldbruskkirtlen på 25% gives det som 0,46 mGy / MBq for mavevæggen , 0,04 mGy / MBq for æggestokkene , 0,07 mGy / MBq for det røde knoglemarv og 0,035 mGy for leveren / MBq og testiklerne med 0,028 mGy / MBq. I skjoldbruskkirtelmålvævet er den (ønskede) strålingsdosis derimod fire til fem kræfter på ti højere: med en optagelse på 25% ved 350 mGy / MBq.
De kohortestudier af Hall 1992 med mere end 45.000 patienter og Ron 1998 med over 35.000 patienter fandt ikke nogen øget kræft dødelighed hos patienter behandlet med radioaktivt jod. Den amerikanske Thyroid Association har foreslået en mulig, minimalt øget forekomst af kræft i skjoldbruskkirtlen efter behandling.
Akutte bivirkninger
Akutte bivirkninger forekommer kun i nogle få tilfælde ; disse er for det meste harmløse. Den mest almindelige er radiothyroiditis, en smertefuld inflammatorisk reaktion i skjoldbruskkirtlen forårsaget af de akutte effekter af stråling, som kan forekomme omkring tre til fem dage efter indtagelse af radiojod. Afkøling og antiinflammatoriske lægemidler såsom ikke-steroide antiinflammatoriske lægemidler eller glukokortikoider kan normalt lindre symptomerne, som aftager inden for få dage. Hævelse, der ledsager betændelse i skjoldbruskkirtlen, kan kun føre til alvorlige problemer såsom åndenød, hvis luftrøret er indsnævret (luftrørstenose), så det anbefales i disse tilfælde forebyggende antiinflammatorisk behandling.
Inflammatoriske hævelser i spytkirtlerne forekommer normalt kun under aktiviteter med højere terapi.
Eksisterende hyperthyreoidisme kan forværres omkring syv til ti dage efter behandlingsstart på grund af begyndelsen af celledeling og den tilknyttede frigivelse af hormoner, der blev opbevaret i skjoldbruskkirtlen. Denne komplikation kan undgås ved at etablere en normal metabolisk situation inden behandling.
En sjælden bivirkning efter radiojodterapi på grund af skjoldbruskkirtelautonomi ( fx autonomt adenom ) er den yderligere forekomst af immunogen hyperthyreoidisme et par uger senere. Dette fænomen kaldes Marine-Lenhart syndrom og er for det meste selvbegrænsende. Frekvensen er angivet som 0,5 til 1%. I nogle af tilfældene skal der dog udføres en anden radiojodterapi på grund af den nyudviklede hyperthyreoidisme.
Udskrivning efter behandling
I Tyskland er den mindste opholdsperiode på terapiafdelingen 48 timer. Udledningen afhænger af den resterende aktivitet, der er tilbage i kroppen. I 1999 blev grænseværdien for restaktivitet øget: Dosishastigheden må ikke overstige 3,5 µSv pr. Time i en afstand på 2 meter fra patienten , hvilket betyder, at strålingseksponeringen på 1 mSv ikke overskrides inden for et år i en afstand af 2 meter. Dette svarer til en restaktivitet på ca. 250 MBq . Lignende regler gælder for Østrig.
I Schweiz må strålingseksponering på maksimalt 1 mSv om året for "andre mennesker" og maksimalt 5 mSv om året for pårørende til patienten ("ikke-professionelle plejere") ikke overskrides. Ved udskrivning efter radiojodterapi er en dosis på højst 5 µSv pr. Time i en afstand på 1 meter tilladt, hvilket svarer til en restaktivitet på omkring 150 MBq.
I Tyskland er den gennemsnitlige opholdsperiode omkring tre til fem dage og afhænger i høj grad af målvolumen. I tilfælde af meget store strømme kan opholdets længde nå op på ti dage.
Ved udskrivelse underrettes patienten om alle strålingsbeskyttelsesforanstaltninger, der stadig skal overholdes. Disse vedrører især håndtering af små børn og gravide kvinder. Patienten skal informeres om mulige problemer med radioaktivitetsmålinger - i lufthavne, atomkraftværker, bortskaffelse af affald - og patienten får om nødvendigt et tilsvarende certifikat.
I særlige tilfælde - for eksempel en akut sygdom hos patienten, som nødvendiggør en undersøgelse og behandling af patienten uden for terapiafdelingen - er en tidlig udskrivning mulig i Tyskland. Dette skal rapporteres til tilsynsmyndigheden op til en dosis på 17,5 µSv / h; godkendelse skal opnås fra 17,5 µSv / h. Hvis patienten overføres til en anden afdeling, skal den ansvarlige strålebeskyttelsesofficer sikre, at der træffes passende strålingsbeskyttelsesforanstaltninger der, for eksempel er der oprettet et midlertidigt kontrolområde .
Opfølgning og succes

I Tyskland er den læge, der udførte radiojodterapi, også ansvarlig for opfølgningen. Den kompetente læge, der er ansvarlig for udførelsen af behandlingen, skal registrere og dokumentere virkningerne og bivirkningerne af nuklearmedicinsk behandling ved hjælp af passende opfølgende undersøgelser, der udføres med passende intervaller hvis det er nødvendigt, skal han starte behandlingen. Nuklearmedicinsk specialist kan aflevere dele af opfølgningen til en professionelt kvalificeret læge, der skal informere ham om resultaterne af opfølgningen. Dette fritager dog ikke nuklearmedicinsk specialist fra sit ansvar for opfølgning.
Afhængigt af behandlet skjoldbruskkirtelsygdom og metabolisk status eller lægemiddelbehandling vil den indledende kontrol af thyroidea laboratorieværdier efter fire til seks uger blive udført, muligvis også mere sandsynligt at udvikle en i Graves sygdom hypothyroidisme kan ses med tiden. Især med allerede eksisterende endokrin orbitopati kan hypofunktion have ugunstige virkninger og skal derfor behandles på et tidligt tidspunkt.
I de fleste tilfælde forekommer den fulde effekt af radiojodterapien i de første tre til seks måneder, så efter denne periode skal en afsluttende undersøgelse for at vurdere den terapeutiske effekt og succes skyldes. Ud over at bestemme skjoldbruskkirtelhormoner inkluderer dette normalt også et skjoldbruskkirtelsonogram og et scintigram . Da der i nogle af tilfældene kan forventes en vis forsinket effekt af radiojodterapien selv efter seks måneder, bør indikationen for gentagelse af behandlingen ikke gives for tidligt.
Forskellige behandlingsmål og succesrater gælder for de forskellige indikationer for radiojodterapi. For autonomi af skjoldbruskkirtlen er målet at slukke for de autonome dele af skjoldbruskkirtlen. Med en måldosis på 300 til 400 Gy gives en succesrate på over 90%. Ca. 10% af patienterne skal behandles permanent med skjoldbruskkirtelhormoner på grund af en underaktiv skjoldbruskkirtel efter behandling ("substitution"). I tilfælde af fokal autonomi kan der forventes et fald i de autonome områders volumen på omkring 80%. Faldet i volumen af den totale skjoldbruskkirtel er 20 til 50%.
I Graves sygdom er målet at eliminere hyperfunktionen permanent. Med begrebet ablativ terapi med måldosen 200 til 300 Grå er succesraten over 90%. Imidlertid er 80 til 90% af patienterne derefter permanent afhængige af substitution med skjoldbruskkirtelhormoner. I det såkaldte funktionsoptimerede koncept med en målrettet fokusdosis på omkring 150 Gray er antallet af underfunktioner, der kræver behandling, kun 40%, men succesraten er kun omkring 70%. Denne lave succesrate er uacceptabel, især i tilfælde af vanskelige forløb med overfunktion, der er vanskelig at kontrollere med medicin, øjeninddragelse ( endokrin orbitopati ) eller gentagne tilbagefald, så begrebet ablativ terapi nu overvejende anvendes. Med hensyn til den alternative behandlingsmetode til radiojodterapi, kan struma resektion , en underfunktion, der kræver behandling, også forventes.
Målet med terapi for struma uden hyperfunktion er primært en reduktion i skjoldbruskkirtlen og eliminering af symptomer forårsaget af struma. Med et indledende volumen på 50 til 100 ml kan man forvente en størrelsesreduktion på ca. halvdelen, når det gælder meget stor struma med et volumen på over 250 ml, kun en reduktion på ca. 30 til 40%. I alt over 80% af tilfældene opnås en forbedring af symptomerne.
Radiojodterapi til ondartede skjoldbruskkirtelsygdomme
Grundlæggende
De epiteliale carcinomer i skjoldbruskkirtlen, nemlig de mest almindelige undertyper papillært carcinom (ca. 70%) og follikulært carcinom (ca. 20%), og deres aflejringer ( metastaser ) har stadig markante ligheder med deres oprindelige væv . På den ene side udtrykker de natriumjodidsymporteren og har derfor evnen til at opbevare jod, på den anden side producerer de thyroglobulin , som derfor kan tjene som en tumormarkør . Skjoldbruskkirtelcarcinomer er ofte synlige som kolde knuder i en skjoldbruskkirtelscintigrafi , dvs. tendensen til at opbevare jod er mindre udtalt end i det omgivende sunde skjoldbruskkirtelvæv. Når det stimuleres med høje niveauer af TSH , er der også en optagelse af jod i maligne ( ondartede ) skjoldbruskkirtelceller.
Ansøgning
Der skal skelnes mellem radiojodterapi til fjernelse ( ablation ) af eventuelle rester af sundt skjoldbruskkirtelvæv i betydningen understøttende terapi, der forenkler efterbehandling ( adjuvans ) og behandling af eventuelle tumorrester eller aflejringer (metastaser) med krav om heling ( kurativ terapi ) eller i det mindste for at forlænge levetiden og lindre symptomer ( palliativ terapi ).
En indikation af ablativ radiojodterapi findes i næsten alle tilfælde af epitelial skjoldbruskkirtelkræft. Kun i tilfælde af papillært mikrocarcinom (størrelse mindre end 1 cm, pT1 N0 M0 ) kan der undgås en ablativ radiojodterapi under visse omstændigheder.
Radiojodterapi er normalt ikke indiceret i medullær eller anaplastisk skjoldbruskkirtelcancer, da disse tumorer generelt ikke opbevarer jod. Graviditet og amning betragtes som en absolut kontraindikation.
forberedelse
kirurgi
Før radiojodterapi til epitelialt skjoldbruskkirtelcancer udføres der altid skjoldbruskkirurgi, som normalt udføres som skjoldbruskkirtelektomi . En lille mængde godartet skjoldbruskkirtelvæv er næsten altid tilbage. I tilfælde af vanskelige kirurgiske tilstande - for eksempel i tilfælde af meget store struma eller tidligere opererede patienter - kan denne rest være større, men dette betyder ikke nogen ulempe for den videre behandling af patienterne og deres udsigter til at overleve ( prognose ) . Det anbefales derfor ikke at stræbe efter en fuldstændig fjernelse af skjoldbruskkirtlen for at undgå skader på den tilbagevendende strubehovednerv bag skjoldbruskkirtlen .
Hvis der er resterende tumorer, hvis der allerede er bosættelser ( metastaser ), eller hvis der er et lokalt tilbagefald ( tilbagefald ), skal der først gøres et forsøg kirurgisk for at reducere mængden af ondartet væv så meget som muligt.
Jod forlader
Endnu mere end ved radiojodterapi til godartede skjoldbruskkirtelsygdomme (se ovenfor ) skal der udvises forsigtighed i fasen forud for radiojodterapi for skjoldbruskkirtelcancer ikke at give patienten yderligere jod.
Stimulering af skjoldbruskkirtelvæv og jodtest
Før den ablative radiojodterapi bør der foretages en (forkortet) radiojodtest (se ovenfor ), der varer 24 timer. I tilfælde af høj optagelse udføres terapien med nedsat aktivitet for at undgå lokale komplikationer - og muligheden for, at yderligere behandling senere vil være nødvendig for at fjerne eventuelle rester, accepteres. Hvis optagelsen er meget høj, bør en anden operation for at reducere skjoldbruskkirtlen væv overvejes.
For at øge ablativ terapi optagelsen af radiojod i skjoldbruskkirtelresten eller nå frem til den helbredende eller palliative terapi i al væsentlig registrering, har de resterende skjoldbruskkirtelceller et højt niveau af TSH stimuleret ( stimuleret ) er. TSH-værdien skal være over 30 mU / l, normal (afhængigt af laboratoriet) er omkring 0,4 til 4 mU / l. Denne høje værdi opnås sædvanligvis ved, at patienten oprindeligt ikke behandles med skjoldbruskkirtelhormoner efter operationen (substitution), som det er sædvanligt efter en komplet (thyroidektomi) eller omfattende skjoldbruskkirtelfjerning (subtotisk struma- resektion ) ved godartede skjoldbruskkirtelsygdomme. Cirka tre til fire uger efter operationen er patienten derefter i en dyb skjoldbruskkirtel underaktiv funktion ( hypothyroidisme ). Ofte er der manglende evne til at arbejde på grund af underfunktionen, og patienterne bør informeres om, at de ikke har lov til at føre motorkøretøj eller kontrollere farlige maskiner i denne fase på grund af nedsat reaktionsevne .
Som et alternativ til hypofunktion har genetisk manipuleret, rekombinant , humant TSH ( rhTSH ) været tilgængeligt i en række år , som kan gives intramuskulært, og med hvilke TSH-niveauer normalt er langt over 30 på den tredje og fjerde dag ved injektioner på to på hinanden følgende dage mU / l.
Mulige fordele ved at bruge rhTSH frem for hypothyroidisme er: bedre generel trivsel; evne til at modtage arbejde Mangel på vedvarende vækststimulus for kræftceller, der stadig kan være til stede på grund af øget TSH i flere uger; Lavere koncentration af iod-131 i serum på grund af normal nyrefunktion - i hypothyroidisme er nyrefunktionen normalt midlertidigt begrænset - og dermed lavere strålingseksponering. Succesraterne for ablativ radiojodterapi er lige så høje i hypofunktion og med rhTSH.
Mulige ulemper, der skal nævnes, er: signifikant forkortet effektiv halveringstid ; øgede mængder ikke-radioaktivt iod i patientens krop på grund af fortsat administration af skjoldbruskkirtelhormoner (indeholdende iod); mangel på bevis for ækvivalens i behandlingen af metastaser manglende evne til at følge op på en diagnose med radiojodterapi, da TSH-niveauet falder igen inden for få dage; høje omkostninger.
udførelse
Standard aktivitet for ablativ radioaktivt jod terapi er 3,7 GBq . (I den forældede enhed svarer dette til Curie 100 mCi .) Hvis der forbliver signifikante rester af skjoldbruskkirtelvæv efter operationen og før den første (ablative) radiojodbehandling, er en lavere aktivitet på 1,1 til 1,85 GBq (svarende til 30 til 50 GBq mCi ) bruges til at undgå strålingsinduceret betændelse i nærliggende væv.
Hvis - selv efter at de kirurgiske muligheder er opbrugt - det stadig kan antages, at ondartet væv har været i patientens krop, dvs. en resterende tumor, en lokal gentagelse eller metastaser er til stede, anvendes højere aktiviteter. Disse er for det meste i området fra 3,7 til 11,1 GBq (100 til 300 mCi), i individuelle tilfælde væsentligt højere.
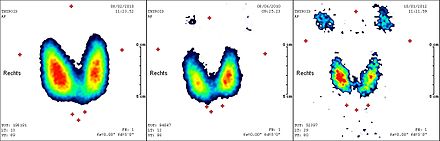
Et fuldkropsscintigram fremstilles et par dage efter behandlingen . Terapien gentages med cirka tre måneders intervaller, indtil hverken scintigram, ultralydsbillede af nakkeområdet eller tumormarkør thyroglobulin indikerer noget signifikant resterende skjoldbruskkirtelvæv (godartet eller ondartet). En total aktivitet på op til 74 GBq (2000 mCi) over alle udførte radiojodbehandlinger tolereres normalt uden problemer hos ellers raske patienter. Når man udfører højere aktiviteter, er der en øget risiko for permanent skade på knoglemarven som et bloddannende organ.
Med hensyn til udskrivning efter behandling gælder de samme frister og grænseværdier som for behandling af godartede skjoldbruskkirtelsygdomme (se ovenfor ) .
Risici og bivirkninger
I tilfælde af uønskede effekter af radiojodterapi skal der sondres mellem de kortsigtede og akutte bivirkninger fra de langvarige og kroniske bivirkninger , og der skal tages hensyn til deres respektive frekvenser og konsekvenser (" risici ") konto.
Sammenlignet med behandlingen af godartede skjoldbruskkirtelsygdomme involverer skjoldbruskkirtelcarcinom undertiden betydeligt højere aktiviteter. Den ønskede højere strålingsdosis i målvævet ( fokaldosis ) er således også forbundet med højere strålingsdoser i andet væv.
Tab af appetit, ændringer i smag, kvalme og irritation af spytkirtlerne forekommer relativt hyppigt under behandlingen; sjældent er nakkesmerter eller hævelse, hovedpine eller midlertidige ændringer i blodtal.
Alvorlige langtidsvirkninger er sjældne og påvirker normalt spyt- og tårekirtler (især nedsat tåre- eller spytproduktion), knoglemarv (meget sjældent hos patienter> 45 år, knoglemarvsdepression eller myeloid leukæmi), lunger (meget sjældent stråling -induceret lungebetændelse, især forværring i tilfælde af allerede eksisterende lungebetændelse eller ny forekomst i diffuse lungemetastaser) og æggestokke (midlertidig mangel på ægløsning, let øget hyppighed af misdannelser under graviditet inden for det første år efter behandling) eller testikler ( azoospermi - sjældent permanent). Fordelen ved radiojodterapi overstiger antallet af bivirkninger 4 til 40 gange. Den forventede forekomst af sekundær kræft eller leukæmi er dosisafhængig. En minimal stigning i sekundære carcinomer blev fundet i organerne (spytkirtler, tyktarm og blære), hvor jod-131 også midlertidigt akkumuleres i betydelige mængder under behandlingen. En engelsk undersøgelse af 7417 patienter viste et statistisk signifikant fald i forekomsten af kræft i luftvejene ( bronkier og luftrør ).
De uønskede virkninger på spytkirtlerne kan reduceres, hvis patienten tygger tyggegummi eller suger surt slik under behandlingen. Begge disse øger spytstrømmen, forkorter opholdstiden for radioaktivt iod i spytkirtlerne og reducerer således stråledosis i spytkirtlerne. Hvis der er en strålingsinduceret inflammatorisk reaktion i spytkirtlerne ( sialadenitis ), kan symptomerne lindres ved lokal afkøling og brugen af ikke-steroide antiinflammatoriske lægemidler .
Opfølgning: diagnosticering af radiojod
Radioaktivt jod bruges ikke kun til behandling af kræft i skjoldbruskkirtlen, men også til opfølgning efter skjoldbruskkirtelkirurgi og ablativ radiojodterapi.
Proceduren - med iodafholdenhed, stimulering af TSH med efterfølgende bestemmelse af tumormarkør thyroglobulin og oral indgivelse af iod såvel som udførelse af hele kroppen scintigrafi - svarer til proceduren til ablativ terapi. I modsætning hertil adskiller det administrerede aktivitetsniveau, omkring 100 til 400 MBq iod-131 eller 40 til 200 MBq iod-123 er sædvanlige.
En indikation for radiojoddiagnostik er normalt tre til seks måneder efter ablativ radiojodterapi for at kontrollere terapi, hvis tumormarkør thyroglobulin stiger, eller hvis der er anden mistanke (f.eks. På grund af kliniske fund eller billeddannelsesprocedurer ) om tilbagefald af kræft ( tilbagefald) ). Hvis og hvornår for patienter, der på grund af deres indledende fund som højrisikopatienter (højrisiko) en Radiojoddiagnostik giver mening, blev klassificeret, selv uden konkret mistanke om gentagelse, er emnet videnskab. Der er ingen retningslinjer eller evidensbaserede resultater om dette.
Påvisning af resterende væv eller metastaser i forbindelse med radiojoddiagnostik fører normalt til en ny radiojodterapi.
Succeser og fiaskoer
Chancerne for bedring fra differentierede skjoldbruskkirtelcarcinomer er generelt meget gode, især da de er tilgængelige for radiojodterapi. For behandlede patienter gives gennemsnitlige 10- års overlevelsesrater på over 90% for papillær og ca. 80% for follikulær variant. De prognostiske faktorer er patientens alder såvel som størrelse, omfang og histologisk differentiering af tumoren; Lymfeknudemetastaser ser ikke ud til at have stor indflydelse på prognosen . På grund af den øgede risiko for gentagelse er konsekvent opfølgning særlig vigtig.
Undersøgelser med et stort antal patienter og over lange observationsperioder viser, at radiojodterapi sænker hyppigheden af lokale tilbagefald (lokale tilbagefald ) og risikoen for at dø af skjoldbruskkirtelkræft ( dødelighed ), især når de udføres rutinemæssigt efter operationen.
Resultaterne af radiojodterapi hos patienter, der allerede har fjernmetastaser, er inkonsekvente. Metastaser i leveren eller lungerne, der opbevarer jod, kan let behandles. I modsætning hertil kan selv knoglemetastaser, der absorberer jod godt, næppe påvirkes. Generelt anvendes radiojodterapi til metastaser, når en kur ikke længere er mulig gennem operation. Inden radiojodterapi bør der dog gøres et forsøg på kirurgisk at reducere den samlede tumormasse. Hvis en (fornyet) operation muligvis vil være forbundet med betydelig lokal skade, vil man i individuelle tilfælde med meget langsomt voksende tumorer beslutte sig for operationen med efterfølgende radiojodterapi, men kun behandle med L-thyroxin.
Situationen er vanskelig, hvis metastaser mister deres evne til at opbevare jod i løbet af behandlingen ( differentiering ). Disse metastaser genkendes ikke i radiojoddiagnostik og kan ikke nås ved radiojodterapi. Positronemissionstomografi (PET) med fluorodeoxyglucose (FDG) anvendes til diagnose . Da kemoterapi og strålebehandling heller ikke tillader en kur, forsøges der at opnå en re-differentiering med administrationen af isotretinoin . Den efterfølgende radiojodterapi viser i det mindste delvis succes i ca. 20 til 35% af tilfældene.
historie

Inden op til brugen af radiojodterapi blev postoperativ postoperativ bestråling (med røntgenstråler) generelt brugt og betragtet som effektiv til kræft i skjoldbruskkirtlen. Imidlertid var diagnosen skjoldbruskkirtelcancer stadig et stort problem i midten af forrige århundrede, så der sandsynligvis vil være en overlapning af udtryk i datidens litteratur.
I 1939 og 1940 offentliggjorde Joseph G. Hamilton værker om iodmetabolismen i skjoldbruskkirtlen ved hjælp af radioaktivt jod hos raske forsøgspersoner og dem med struma med forskellige patogenese . I tidligere år havde han allerede undersøgt virkningerne af radioaktivitet på menneskekroppen.
I 1942 offentliggjorde Saul Hertz fra Massachusetts General Hospital og fysikeren Arthur Roberts deres rapport om den første radiojodterapi (1941) for Graves sygdom , på det tidspunkt stadig overvejende med isotopen jod-130 (halveringstid 12,4 timer). Et par måneder senere - også i 1941 - udførte Joseph Hamilton og John H. Lawrence den første behandling med jod-131 - den isotop, der stadig bruges i dag. I 1942 beskrev AS Keston et al. I et casestudie anvendelsen af radioaktivt iod til terapeutiske og diagnostiske formål i en metastase af skjoldbruskkirtelcancer i lårbenet, der ikke havde reageret på den daværende almindelige behandling med røntgenstråler. En anden casestudie fra 1942 viser, at dette på ingen måde var en rutinemæssig procedure for kræft i skjoldbruskkirtlen.
Samuel M. Seidlin (1895–1955, dengang leder af endokrinologiafdelingen på Montefiore Hospital i New York City ) brugte først jod-131 til metastatisk skjoldbruskkirtelkræft i 1946.
Den første radiojodterapi til kræft i skjoldbruskkirtlen i Europa blev udført i 1948 på Luisen Hospital Aachen af Cuno Winkler .
litteratur
- F. Grünwald, C. Menzel. Radiojodterapi. I: T. Kuwert, F. Grünwald , U. Haberkorn , T. Krause: Nuklearmedicin. Stuttgart / New York 2008, ISBN 978-3-13-118504-4 .
-
Medicinske retningslinjer :
- Retningslinje for radiojodterapi (RIT) i godartede skjoldbruskkirtelsygdomme fra det tyske selskab for nuklear medicin (DGN) . I: AWMF online (pr. 10/2015)
- Retningslinje procedureanvisning til radiojodtest. fra det tyske selskab for nuklear medicin (DGN). I: AWMF online (pr. 10/2014)
- Retningslinje proceduremæssige instruktioner til radioiodinebehandling (RIT) i differentieret skjoldbruskkirtelkræft. fra det tyske samfund for nuklearmedicin (DGN). I: AWMF online (pr. 10/2015)
- Retningslinje proceduremæssige instruktioner for jod-131 helkropsscintigrafi i differentieret skjoldbruskkirtelcancer. fra det tyske samfund for nuklearmedicin (DGN). I: AWMF online (pr. 07/2017)
Weblinks
- L.-A. Hotze: Historien om radiojodterapi. ( Memento fra 24. juni 2010 i internetarkivet )
Individuelle beviser
- ↑ Frank Grünwald, Karl-Michael Derwahl: Diagnose og behandling af skjoldbruskkirtlen sygdomme. Frankfurt / Berlin 2014, ISBN 978-3-86541-538-7 , s. 109.
- ↑ a b c d e f g h i j k l m n o p q F. Grünwald, C. Menzel: radiojodterapi. I: T. Kuwert, F. Grünwald , U. Haberkorn , T. Krause: Nuklearmedicin. Stuttgart / New York 2008, ISBN 978-3-13-118504-4 .
- ^ A b Lothar-Andreas Hotze, Petra-Maria Schumm-Draeger: Skjoldbruskkirtelsygdomme. Diagnose og terapi. Berlin 2003, ISBN 3-88040-002-4 .
- ↑ a b Guideline of the German Society for Nuclear Medicine (DGN): Radioiodine Therapy (RIT) for godartede skjoldbruskkirtelsygdomme.
- ^ ME Peterson: Radiojodbehandling af hyperthyreoidisme . I: Clin. Teknisk. Lille animation. Øv. , 21 (1) / 2006, s. 34-39, PMID 16584029 , ISSN 1096-2867
- ↑ a b Retningslinje "Strålingsbeskyttelse inden for medicin" (administrative forskrifter-im-internet.de); adgang den 25. marts 2018.
- ↑ LD Marinelli, EH Quimby, GJ Hine: Doseringsbestemmelse med radioaktive isotoper; praktiske overvejelser i terapi og beskyttelse. I: Den amerikanske tidsskrift for roentgenologi og radiumterapi . bånd 59 , nr. 2 , 1948, s. 260-281 , PMID 18905884 .
- ↑ Retningslinje fra det tyske selskab for nuklearmedicin (DGN) : proceduremæssige instruktioner til radiojodtesten. ( awmf.org ).
- ^ A b I. S. Robertson: Dosimetri af radionuklider. I: S. Falk (red.): Skjoldbruskkirtelsygdom. Raven, New York 1997. Citeret fra: F. Grünwald, C. Menzel. Radiojodterapi. I: T. Kuwert, F. Grünwald , U. Haberkorn , T. Krause: Nuklearmedicin. Stuttgart, New York 2008, ISBN 978-3-13-118504-4 .
- ^ P. Hall, G. Lundell, A. Mattsson, K. Wiklund, L. -E. Holm, M. Lidberg, JD Boice, G. Berg, G. Bjelkengren, U. -B. Ericsson, A. Hallquist, J. Tennvall: Leukæmi forekomst efter iod-131 eksponering . I: The Lancet . bånd 340 , nr. 8810 , 1992, s. 1-4 , doi : 10.1016 / 0140-6736 (92) 92421-B , PMID 1351599 .
- ↑ Elaine Ron, Michele Morin Doody, David V. Becker, A. Bertrand Brill, Rochelle E. Curtis, Marlene B. Goldman, Benjamin SH Harris III, Daniel A. Hoffman, William M. McConahey, Harry R. Maxon, Susan Preston -Martin, M. Ellen Warshauer, F. Lennie Wong, John D. Boice, for den kooperative thyrotoksikoserapi Opfølgningsundersøgelsesgruppe: Kræftdødelighed efter behandling for hyperthyroidisme hos voksne . I: JAMA . bånd 280 , nr. 4 , 1998, s. 347-355 , PMID 9686552 ( kræftdødelighed efter behandling for hyperthyroidisme hos voksne ).
- ^ Radioaktivt jod. American Thyroid Association-oplysninger , adgang til 5. oktober 2012.
- ↑ Art. 37 i forordningen om håndtering af uforseglede radioaktive strålingskilder på admin.ch; Hentet 20. marts 2011.
- ↑ Tillæg 5 til forordningen om håndtering af uforseglede radioaktive strålekilder på admin.ch; Hentet 20. marts 2011.
- ↑ a b c d Radiojodterapi ved differentieret skjoldbruskkirtelkræft . Hentet 9. januar 2016.
- ↑ a b c S. M. Chow: Bivirkninger af højdosis radioaktivt iod til ablation eller behandling af differentieret skjoldbruskkirtelcarcinom . I: Hong Kong College Radiolog . Ingen. 8 , 2005, s. 127-135 ( hkcr.org (PDF) [åbnet 13. marts 2008]).
- ↑ DJ Handelsman, AJ Conway, PE Donnelly, JR Turtle: Azoospermia efter iod-131 behandling for skjoldbruskkirtelcancer. I: British Medical Journal. 281, nr. 6254, 1980, s. 1527, PMC 1714914 (fri fuldtekst).
- ↑ Retningslinje fra det tyske samfund for nuklearmedicin (DGN) : proceduremæssige instruktioner til jod-131 helkropsscintigrafi i differentieret skjoldbruskkirtelcancer. ( online ).
- ↑ Austrian Society for Surgical Oncology: Prognose for differentieret (papillær, follikulær) skjoldbruskkirtel ( Memento af 5. marts 2009 i Internetarkivet )
- ↑ NA Saamann et al.: Resultaterne af forskellige behandlingsmetoder for veldifferentieret skjoldbruskkirtelcarcinom; en retrospektiv gennemgang af 1599 patienter. I: J Clin Endocrinol . bånd 75 , 1992, s. 147-154 . og EL Mazzaferri, SM Jhiang: Langvarig virkning af indledende kirurgi og medicinsk behandling på papillær og follikulær skjoldbruskkirtelkræft. I: Am J Med . bånd 97 , 1994, s. 418-428 . citeret fra F. Grünwald, C. Menzel. Radiojodterapi. I: T. Kuwert, F. Grünwald , U. Haberkorn , T. Krause: Nuklearmedicin. Stuttgart, New York 2008, ISBN 978-3-13-118504-4 .
- ↑ AM Smith: thyroideakarcinom. I: Virginia M. Månedligt. 69, 1942, s. 318-324 ( Abstract (PDF) Cancer Res. , 1943; 3, s. 729-808; adgang til 19. december 2009).
- ^ ET Leddy: Behandling af Roentgen Ray af ondartede tumorer. I: M. Clin. Nordamerika. 25, 1941, s. 973-1009 ( Abstract (PDF) Cancer Res. , 1943; 3, s. 425-496; adgang til 19. december 2009).
- ^ C. Bonne: Over Maligne Schildkliergezwellen (ondartede tumorer i skjoldbruskkirtlen). I: South African M, J. 15, 1941, s. 147-152 ( Abstract (PDF) Cancer Res. , 1943; 3, s. 281-352; adgang til 19. december 2009).
- ^ Joseph G. Hamilton, Mayo H. Soley: Undersøgelser i jodmetabolisme af skjoldbruskkirtlen in situ ved anvendelse af radiojod hos normale forsøgspersoner og hos patienter med forskellige typer struma. I: American Journal of Physiology . 131, 1940, s. 135-143.
- ^ Joseph G. Hamilton og Mayo H. Soley: Undersøgelser i jodmetabolisme ved anvendelse af en ny radioaktiv isotop af jod. I: American Journal of Physiology. 127, 1939, s. 557-572.
- ^ Joseph G. Hamilton, Gordon A. Alles: Den fysiologiske virkning af naturlig og kunstig radioaktivitet. I: American Journal of Physiology. 125, 1939, s. 410-413.
- ↑ Joseph G. Hamilton: Hastighederne for absorption af de radioaktive isotoper af natrium, kalium, chlor, brom og iod i normale humane individer. I: American Journal of Physiology. 124, 1938, s. 667-678.
- ^ S. Hertz, A. Roberts: Anvendelse af radioaktivt iod til behandling af Graves sygdom . I: J Clin Invest . bånd 21 , nr. 6 , 1942, s. 624 . citeret fra: Martin Metten: Effekten af dosishastigheden på den terapeutiske succes med radiojodterapi i funktionelle skjoldbruskkirtel-autonomier . DNB 96838837x (afhandling, 2002, Justus Liebig University Giessen).
- ↑ Ralf Paschke, Peter Georgi: Terapi af uni- eller multifokal skjoldbruskkirtlen autonomi. (PDF) I: Dtsch Arztebl. 97, nr. 47, 2000, s. A-3197, adgang til 19. december 2009.
- ↑ a b L.-A. Hotze. Historien om radiojodterapi. Arkiveret fra originalen den 24. juni 2010 ; adgang 31. december 2009 .
- ^ AS Keston, RP Ball, VX Frantz, WW Palmer: Opbevaring af radioaktivt iod i en metastase fra skjoldbruskkirtelcarcinom. I: Videnskab. 95, 1942, s. 362-363, doi: 10.1126 / science.95.2466.362 ( Abstract (PDF; 793 kB) Cancer Res. , 1943; 3, s. 281-352; adgang til 19. december 2009).
- ↑ HT Wikle, AJ Ritzmann: Forløbet af carcinom i skjoldbruskkirtlen. Rapport om en usædvanlig sag. I: Am J Surg 5, nr. 6, 1942, s. 507-512 doi: 10.1016 / S0002-9610 (42) 90721-9 ( abstrakt (PDF; 793 kB) Cancer Res. , 1943; 3, s. 281 -352; adgang til 19. december 2009).
- ↑ SM Seidlin, LD Marinelli, E. Oshry: Radioaktivt jod behandling: virkning på fungerende metastaser af adenocarcinom i skjoldbruskkirtlen. I: JAMA . bånd 132 , 1946, s. 838 .
- ^ E. Siegel: Begyndelsen af radiojodterapi af metastatisk skjoldbruskkirtelcarcinom: en memoir af Samuel M. Seidlin, MD (1895–1955) og hans berømte patient. I: Cancer Biother Radiopharm . bånd 14 , 1999, s. 71 .
- ↑ C. Winkler: Radioaktivt iod til behandling af ondartede skjoldbruskkirteltumorer. I: Verh Dtsch Ges Inn Med . bånd 56 , 1950, s. 180 . citeret fra L.-A. Hotze. Historien om radiojodterapi. Arkiveret fra originalen den 24. juni 2010 ; Hentet 7. februar 2012 .