FeLV-infektion
En infektion med feline leukæmivirus (FeLV) kan forårsage alvorlig sygdom hos katte. Virussen fra Retroviridae- familien , der hovedsageligt overføres fra kat til kat gennem spyt, forårsager alvorlige sygdomssymptomer hos nogle af de inficerede dyr, som kan være meget varierende. Ud over lymfomer , dvs. ondartede tumorer i lymfevævet , er de mest almindelige tegn på sygdom et svækket immunsystem og anæmi .
Ikke alle inficerede dyr udvikler kliniske symptomer. Katte med tilstrækkelig immunkompetence formår at overvinde infektionen på et tidligt tidspunkt. Hos de andre dyr, efter infektion, kommer virussen først gennem de orale og nasale slimhinder i lymfevævet i nasopharynx, hvorfra den spreder sig gennem blodbanen til knoglemarven , hvor den inficerer de bloddannende stamceller og stamceller og til sidst med blodcellerne fordeles det over hele kroppen. Virus replikerer konstant i kroppen af disse katte, som er kendt som " gradvis inficeret ". Store mængder viruspartikler kan påvises i blodet, som udskilles i kropsvæskerne, især i spyt, så disse katte udgør en infektionskilde for andre dyr.
Som retrovirus integrerer den feline leukæmivirus sit genetiske materiale i de inficerede værtsceller, som således indeholder al den information, der er nødvendig for virusreplikation i form af et såkaldt provirus . På denne måde kan virussen ikke længere fjernes fra en inficeret kats krop. Der er derfor ingen årsagsbehandling af FeLV-infektion, så palliativ terapi kun kan lindre symptomerne.
Der findes vacciner mod felint leukæmivirus; de beskytter pålideligt katte mod udviklingen af en progressiv infektion og dermed mod udviklingen af sygdommens symptomer, men de kan ikke helt forhindre infektion med virussen. Vaccination anbefales kun til katte, der har potentiel kontakt med andre katte med ukendt FeLV-status.
terminologi
Infektion med felint leukæmivirus er ofte hos katte med tumorer i de hvide blodlegemer associeret, hvorfor der kaldes tilknyttet FeLV-infektionssygdomme, ofte kaldet feline leukæmi eller feline leukæmi . Da FelV-infektionen imidlertid kan være forbundet med adskillige andre og meget variable symptomer, bør dette udtryk ikke bruges synonymt med FeLV-infektionen.
I tysktalende veterinærmedicin bruges udtrykket leukose ofte til systemisk neoplastisk spredning af hvide blodlegemer eller deres forløbere . Faste tumorer i det hæmolymfatiske væv, såsom lymfeknuderne , thymus eller milten , er også ofte inkluderet. Hvis tumorceller er til stede i blodet, taler man om en leukæmisk leukose ; hvis der på den anden side ikke kan påvises tumorceller i blodbanen, taler man om aleukemisk leukose .
Ifølge dette koncept kaldes anvendelser ofte FeLV-infektionen i tysktalende feline leukæmi og den forårsagende virus fejldiagnosticeret som feline leukæmi virus kaldet.
Især i den engelsktalende verden bruges udtrykket leukæmi (leukæmi), der anvendes i human medicin, til ondartede sygdomme i det bloddannende eller lymfesystem . Som med udtrykket leukose inkluderer dette udtryk også solide tumorer i lymfevævet, hvilket forklarer navnet på virussen som felint leukæmivirus , selvom William Jarrett opdagede det hos katte med lymfom og ikke leukæmi var syge.
historie
FeLV-virussen blev først isoleret i 1964 af William Jarrett, en veterinærpatolog ved University of Glasgow . En veterinær i Glasgow gjorde ham opmærksom på den høje forekomst af lymfom blandt de katte, han behandlede. Jarrett indså, at visse grupper af katte, der levede i tæt kontakt med hinanden, havde en ophobning af disse tumorer. I en gruppe katte, der boede sammen i en husstand, fandt han leukæmi hos otte dyr. I en anden husstand med flere katte udviklede de tidligere sunde dyr flere tumorer efter at en avlstomkat blev føjet til gruppen. Observationen om, at sunde killinger også blev syge efter kontakt med syge hvalpe, førte ham til at konkludere, at der skal være et tumorfremkaldende middel, der kan overføres vandret fra dyr til dyr.
Begrebet virusinduceret tumorigenese havde været kendt siden beskrivelsen af Rous sarkomvirus hos kyllinger i 1911 af Francis Peyton Rous , der blev tildelt Nobelprisen i medicin i 1966 for sin opdagelse . I 1930'erne, retrovirus- induceret leukæmi hos mus og Shop s fibromavirus ( leporipoxvirus fibromatose ), der hører til familien af Poxviridae og som inducerer mesenkyme tumorer i kaniner , blev beskrevet
Jarrett og hans kolleger lykkedes at demonstrere, at lymfomer kunne overføres fra et dyr til et andet og ved at isolere vira fra tumorer i milt, thymus og mesenteriske lymfeknuder hos en kat med lymfosarkom og dyrke dem i en cellekultur .
Efter den murine leukæmivirus var den feline leukæmivirus den anden beskrevne retrovirus, der kan inducere tumorer hos pattedyr. Efter en række dyr retrovirus var blevet opdaget, at årsagen maligne sygdomme (herunder bovine leukæmi virus BLV, den fugleleukosevirus virus ALV, musebrysttumorvirus- MMTV, og andre), mange læger var af den opfattelse, at det kun var et spørgsmål tid indtil passende humane onkogene retrovirus blev fundet. Men når dette ikke skete i årtier, eller når der var gentagne falske rapporter og falske alarmer, blev forskningsmiljøet skeptisk. Det var først i slutningen af 1970'erne, at arbejdsgruppen ledet af den amerikanske virolog Robert Gallo lykkedes at opdage de to første humane retrovira, HTLV-1 og HTLV-2 . Da Gallo behandlede den "epidemiske" AIDS , der dukkede op i begyndelsen af 1980'erne , troede han oprindeligt, at et FeLV-lignende retrovirus kunne være udløseren, da han huskede den immunsuppression, der undertiden opstår med FeLV-infektion. I sidste ende blev imidlertid et nyt lentivirus - HIV - identificeret som agenten.
Feline Leukemia Virus
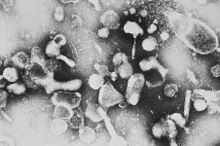
Den feline leukæmivirus tilhører retrovirusfamilien . Som gammaretrovirus indeholder det et enkeltstrenget RNA, som, når virussen replikerer efter infektion af en værtscelle, først transkriberes til dobbeltstrenget DNA af virusets eget enzym, reverse transcriptase, for derefter at blive integreret i genomet af værtscellen. Det integrerede virus-DNA kaldes provirus og er skabelonen til syntese af nye viruspartikler Virusgenomet og dermed den komplette information til virusreplikation er forankret i værtscellen via denne mekanisme; værtsorganismen kan ikke længere fjerne virussen fra kroppen.
Virusreplikationscyklussen inkluderer adskillige muligheder for genetisk variation i at udvikle sig . Processen med at overføre RNA til DNA er relativt udsat for fejl, da enzymet revers transkriptase ikke har nogen kontrolfunktion. Dette resulterer regelmæssigt i mutationer i virusgenomet, hvilket kan føre til nye genetiske varianter. Endvidere forekommer rekombination med gensegmenter af værtscellegenomet regelmæssigt .
Virusgenomet integreret i cellegenomet som et provirus overføres til datterceller under celledeling. I løbet af evolutionen har komplette endogene FeLV-proviruses etableret sig på forskellige steder i genomkatens genom , som videreføres til efterfølgende generationer via kimlinjen. Transkriptionsprodukter af disse endogene vira kunne detekteres i forskellige organer hos katten, så hvis en celle er inficeret med FeLV-A, kan der forekomme en rekombination mellem det eksogene FeLV-A og de endogene FeLV-transkriptionsprodukter.
På grund af den høje grad af mutationer og rekombinationer i virusreplikation repræsenterer FeLV en gruppe genetisk meget nært beslægtede vira, der er karakteriseret ved høj genetisk variation . Der skelnes mellem de fire undertyper FeLV-A, FeLV-B, FeLV-C og FeLV-T, som adskiller sig i sekvensen af env- genet, de receptorer, der anvendes til infektion af værtsceller og deres celle- tropisme .
Af de fire undertyper er FeLV-A den overførbare og infektiøse form af felint leukæmivirus og den eneste undertype, der i sig selv er smitsom . Det kan detekteres hos alle naturligt inficerede katte, med adskillige forskellige genetiske varianter, der hidtil er blevet isoleret.
FeLV-B-undertypen opstår de novo hos katte inficeret med FeLV-A gennem en rekombination mellem FeLV-A og sekvenser af det endogene FeLV- env- gen i værtscellen. Det kan kun overføres fra kat til kat sammen med FeLV-A-undertypen. Katte inficeret med FeLV-B-undertype er mere tilbøjelige til at udvikle lymfomer end dyr inficeret med FeLV-A alene. Prognosen er meget dårligere.
FeLV-C-undertypen opstår de novo hos FeLV-A-inficerede katte gennem en mutation. Infektioner med undertypen FeLV-C forårsager svær, dødelig ikke-regenerativ anæmi . Det forekommer dog sjældent og kan ikke overføres fra kat til kat. Infektioner med den fjerde undertype FeLV-T er forbundet med en alvorlig svækkelse af immunsystemet og fysisk tilbagegang.
Distribution og epidemiologi
Værtsspektrum
FeLV-infektion er udbredt over hele verden. Feline leukæmi-virus har en relativt streng værtsspecificitet for arter fra kattefamilien (Felidae) . Ud over huskatten ( Felis catus ) er der også rapporteret om FeLV-infektioner hos vilde katte ( Felis silvestris ) , den eurasiske los ( Lynx lynx ) , den iberiske los ( Lynx pardinus ) , pumaen ( Puma concolor ) og den chilenske vildkat ( Leopardus guigna) ) bevist. Det er ikke smitsomt for ikke-katte, så der er ingen risiko for infektion for mennesker.
FeLV-infektioner er sjældne i ikke-tamme arter af Felidae-familien. De fleste af de hidtil beskrevne infektioner i vilde dyr er blevet påvist hos dyr i fangenskab og kunne spores tilbage til direkte kontakt med FeLV-inficerede huskatte. I næsten alle efterkontrollerede tilfælde var de inficerede dyr i stand til fuldstændigt at eliminere virussen, hvorfor virusen ikke blev overført til andre specifikke her.
Da der ikke er fundet endogene FeLV-vira i andre kattearter end huskatte , blev det postuleret, at FeLV kan inficere forskellige arter af kattefamilien, men kun patogen for huskatte. Denne hypotese måtte revideres efter et FeLV-udbrud i Florida- panterpopulationen ( Puma concolor coryiin ) i 2001-2006 og påvisning af FeLV-inficeret iberisk los i Spanien i 2004-2007, efter at begge tilfælde vidste, at flere dyr var døde fra infektionen. Da begge udbrud ramte populationer af en art, der var truet af udryddelse, og FeLV-viræmi blev påvist i flere klinisk syge og døde dyr, betragtes FeLV-infektion nu også som en trussel mod bevarelsen af truede arter, især hvis kun nu små restpopulationer lever i begrænset geografiske områder og med tæt kontakt mellem dyrene.
Udbredelse
I Europa, USA og Canada er omkring 1% -10% af huskatte inficeret med virussen. Den Udbredelsen er primært påvirket af tætheden af en kat befolkning og de specifikke boligforhold kattene, således at der er store geografiske og lokale forskelle. I de fleste lande er mindre end 1% af de katte, der holdes individuelt, inficeret med virussen. I husstande, hvor flere katte holdes i tæt kontakt med hinanden, og hvor der ikke træffes særlige forholdsregler mod overførsel af infektionen, såvel som i grupper af vildtlevende huskatte, kan prævalensen overstige 20%. Hos katte, der blev testet under en sygdom, kunne infektionsfrekvenser på op til 30% påvises, hvilket indikerer virusets særlige betydning som et patogen.
Indtil 1990'erne kunne omkring en tredjedel af alle tumorassocierede dødsfald hos katte spores tilbage til FeLV-infektion. Da adskillige dyr også døde af FeLV-associeret anæmi og sekundære infektioner forårsaget af det svækkede immunsystem, var FeLV-infektionen ansvarlig for størstedelen af sygdomsrelaterede dødsfald hos katte i løbet af denne periode.
I de sidste par årtier er forekomsten og dermed betydningen af katte leukæmivirus som et patogen faldet markant. Dette skyldes tilgængeligheden af pålidelige diagnostiske tests og vacciner, omfattende test- og eliminationsprogrammer og bedre viden om patogenesen og infektionsforløbet.
smitte
Virussen kan overføres både vandret og lodret.
Viræmiske katte udskiller store mængder af virussen i deres spyt, næsesekretioner, tårer, afføring, urin og modermælk. Infektionen sker normalt ved direkte kontakt med inficerede dyr, især gennem spyt. Den indirekte transmission gennem genstande, der er kontamineret med virusholdigt spyt eller andre kropsvæsker såsom fodring eller drikkeskåle, er af ringe betydning, da virussen deaktiveres uden for katten ved stuetemperatur inden for få minutter. Men det kan forekomme under dårlige hygiejniske forhold, hvis det f.eks. B. spiser flere katte fra en skål på samme tid. Den vigtigste overførselsrute er venlig kontakt mellem katte, såsom at slikke hinanden til gommen. Men infektionen kan også overføres via bid eller endda bare bidforsøg, hvor spyt overføres, for eksempel i rangkampe eller under parring.
Virussen overføres lodret fra viræmiske drægtige katte, dvs. fostrene kan inficeres gennem moderkagen (transplacental). Dette fører dog normalt til deres død og / eller aborter . Transplacentalt inficerede hvalpe viser allerede viræmi ved fødslen, bekymrer sig og dør efter kort tid ( falmende killingsyndrom ).
Med stigende alder bliver katte mere og mere resistente over for FeLV-infektion, så killinger og killinger er særligt udsatte for infektion. Fritgående katte har især risiko for FeLV-infektion, da de kan have kontakt med dyr med ukendt FeLV-status. Dette gælder især for ikke-kastrerede dyr, da de oftere er involveret i territoriale kampe, og infektionen også kan overføres ved tæt kontakt under parring. Yderligere risikofaktorer for en infektion er at holde katte i større grupper med skiftende kaster, en høj lokal kattæthed og dårlige hygiejniske forhold.
Infektionsforløb
Infektionen med den feline leukæmivirus er kronisk og er karakteriseret ved en lang asymptomatisk fase, hvor de berørte katte ikke viser kliniske sygdomstegn.
Efter at virussen er blevet absorberet gennem mund- eller næseslimhinden, formerer den sig først i det lokale lymfevæv i nasopharynx . Den første viræmi forekommer kun få dage efter infektion , så viruspartikler bundet til lymfocytter og monocytter kan påvises i det perifere blod. Inden for 7 til 14 dage inficeres andre lymfeorganer via blodbanen, især thymus , andre regionale lymfeknuder og Peyer's plader i tyndtarmen. 14 til 21 dage efter den første viruskontakt kan inficerede celler også påvises i knoglemarven, der producerer store mængder viruspartikler, der skylles ud i blodbanen og således forårsager en anden, signifikant stærkere viræmi.
I princippet kan alle hæmatopoietiske celler inficeres af FeLV. Mens oprindeligt hovedsageligt lymfocytter og monocytter er inficeret, viser neutrofiler og blodplader i det senere forløb af infektionen den stærkeste virusreplikation.
Gradientformer
Infektion med FeL-virussen kan tage forskellige former. Selvom det tidligere blev antaget, at katte, der havde overlevet FeLV-infektion uden at udvikle vedvarende viræmi, var immun over for FeLV-infektion, ved vi i dag fra mere følsomme diagnostiske metoder, at de fleste katte, der har FeLV-infektion, efter at have gennemgået infektion forbliver proviruspositive. Indtil videre er det imidlertid uklart, om denne provirus-positive status har klinisk relevans, og hvilken epidemiologisk betydning disse dyr har. Virussen kan ikke påvises i blodet fra disse dyr ved en test for viralt protein, og de udskiller det heller ikke. Men da virussen er integreret i genomet af værtsceller i form af provirus, kan den ikke fjernes fra kroppen. Efter reaktivering af virusreplikation kan der dog principielt forekomme en fornyet viræmi og udskillelse af infektiøse vira.
Baseret på viden om, at der er adskillige dyr, der reagerer negativt på virusantigener i blodet, men som også er provirus-positive, blev der foretaget en ny klassificering af formerne for FeLV-infektionen. Ifølge denne klassificering er infektionerne opdelt i abortive, progressive, regressive og atypiske eller fokale infektioner.
Infektionsforløbet bestemmes hovedsageligt af det inficerede dyrs immunrespons. Katte, hvor infektionen tager et abortivt eller regressivt infektionsforløb, har et højt niveau af cirkulerende FeLV-specifikke cytotoksiske T-lymfocytter (CTL) i blodet, selv før virusneutraliserende antistoffer vises. Gradvis inficerede katte med vedvarende viræmi reagerer derimod kun på infektionen med et reduceret specifikt cellemedieret og humoralt immunrespons.
Alderen på tidspunktet for infektion anses for at være et af de egenskaber ved det inficerede dyr, der mest bestemmer infektionsforløbet. Efter en infektion med den feline leukæmivirus udvikler nyfødte killinger thymusatrofi med alvorlig immunmangel, bekymrer sig og dør efter kort tid. Modstand mod infektionen udvikler sig gradvist med alderen. Ældre katte viser normalt et abortivt eller regressivt infektionsforløb. Hvis de udvikler en progressiv infektion, udvikles der normalt kun milde symptomer, og fasen op til starten af de første symptomer er betydeligt længere.
Abortinfektion
I tilfælde af abortinfektion multiplicerer virussen i det lokale lymfevæv i nasopharynx efter infektion. Katte med tilstrækkelig immunkompetence er i stand til at udvikle et effektivt humoralt og cellemedieret immunrespons, så virussen ikke spredes længere gennem blodbanen i kroppen. I blodet fra disse dyr er der et højt niveau af neutraliserende antistoffer rettet mod virussen , mens FeLV-protein, viralt RNA eller proviralt DNA ikke kan påvises på noget tidspunkt.
Under naturlige infektionsforhold er FeLV-infektion abort hos omkring 20% til 30% af kattene. Ud over tilstrækkelig immunkompetence er forudsætningen sandsynligvis kun et lavt infektionstryk på grund af lave doser FeLV, som dyrene udsættes for. Ifølge den tidligere klassificering blev katte, hvor der ikke kunne påvises virusantigen i blodet efter infektion, kaldet regressorkatte. Ved hjælp af den meget følsomme polymerasekædereaktion blev proviralt DNA faktisk påvist i vævsprøver fra adskillige katte, der tidligere var blevet klassificeret som regressorkatte, hvilket viser, at kun nogle af de inficerede katte faktisk er i stand til fuldstændigt at fjerne FeLV for at eliminere fra kroppen.
Abortinfektionen kan kun påvises ved påvisning af antistoffer rettet mod FeLV i blodet ( serokonversion ). Da virussen fjernes fuldstændigt fra kroppen, har en abort FeLV-infektion heller ingen kliniske konsekvenser i det senere liv. Ingen virus udskilles, så når dyrene har overvundet infektionen, er de ikke en kilde til infektion for andre katte.
Katte, der har haft en aborteret FeLV-infektion, forbliver immune over for reinfektion med virussen hele livet.
Progressiv infektion
I en progressiv infektion gennemgår virussen hele infektionsforløbet fra de lokale lymfeknuder til infektionen i knoglemarvscellerne. Værtsorganismen lykkes ikke med at udvikle en tilstrækkelig immunrespons på infektionen, så der er en kontinuerlig virusreplikation med konstant reinfektion af yderligere kropsceller. Gradvis inficerede katte viser derfor vedvarende viræmi, og store mængder virusprotein kan påvises i deres blod på ethvert tidspunkt efter infektionen i knoglemarven. Dyrene udskiller permanent infektiøse viruspartikler gennem deres spyt, men også gennem tårevæske, afføring, urin og modermælk, så de udgør en infektionskilde for andre katte.
Ca. 30% til 40% af FeLV-inficerede katte udvikler progressiv infektion med vedvarende viræmi. Flere faktorer bestemmer, om en kat udvikler progressiv infektion. Infektion af unge katte op til 16 uger fører i langt de fleste tilfælde til livslang viræmi. Hvis infektionstrykket er højt, eller immunresponset er utilstrækkeligt, kan ældre dyr også blive permanent viræmiske.
Mest progressivt inficerede katte vil udvikle FeLV-associeret klinisk sygdom inden for måneder til år efter infektion. Katte med en progressiv infektion har derfor en dårlig prognose med en signifikant nedsat forventet levetid.
Regressiv infektion
Et regressivt infektionsforløb udvikler sig hos 30% -40% af de katte, der er inficeret med FeLV. Efter den indledende infektion og en indledende multiplikation i det lokale lymfevæv distribueres virussen oprindeligt i hele kroppen af lymfocytter og monocytter via blodbanen (første viræmi). På dette stadium af infektionen kan virusantigen påvises i kattenes blod, og kattene udskiller virussen hovedsageligt gennem deres spyt. I det videre forløb af infektionen lykkes det imidlertid dyrene at forhindre virusreplikation og dermed infektionen af andre kropsceller gennem en passende immunrespons. Infektionen kan være indeholdt inden infektionen i knoglemarven eller i sjældnere tilfælde under den anden viræmi. Dette kan gøres inden for få uger eller i undtagelsestilfælde måneder efter infektionen.
Det molekylære grundlag for den regressive infektion er integrationen af en kopi af virusgenomet (provirus) i det kromosomale DNA fra værtscellerne. Som et resultat kan virussen ikke fjernes fuldstændigt fra kroppen; den genetiske information til virusreplikation forbliver i kroppens celler. Med hver deling af en celle, der bærer provirussen, multipliceres det provirale DNA imidlertid, og den genetiske information overføres til dattercellerne, der dannes, så alle datterceller, der stammer fra de inficerede stamceller, indeholder proviralt FeLV-DNA.
Selvom det provirale DNA er til stede i værtscellen, produceres der ingen virus af cellerne, hvorfor der ikke kan påvises noget FeLV-antigen i de berørte dyrs blod. Ved hjælp af en PCR kan det provirale DNA dog påvises i værtsceller. Dyrene udskiller ikke en virus og er derfor ikke en infektionskilde for andre katte.
Da den komplette genetiske information til dannelse af viruspartikler er tilgængelig hos værtsdyrene, kan en regressiv infektion genaktiveres i tilfælde af et svækket immunsystem, fordi immunresponset bliver for svagt til yderligere at undertrykke virusreplikation. Dåsen z. B. ved kronisk stress, indgivelse af glukokortikoider eller andre immunsuppressive lægemidler eller en infektion med det feline immundefektvirus . Reaktiveringen kan føre til fornyet viræmi og dermed til udskillelse af infektiøse vira. Ifølge den tidligere klassificering blev den regressive infektion derfor kaldet latent infektion. Imidlertid er reaktivering af en regressiv FeLV-infektion sandsynligvis ekstremt sjælden under naturlige forhold.
Den kliniske relevans af den regressive infektion er endnu ikke helt forstået. Det er sikkert, at regressivt inficerede katte har en signifikant lavere risiko for at udvikle FeLV-associerede sygdomme sammenlignet med progressivt inficerede dyr. Sammenlignet med katte, der aldrig har haft kontakt med FeLV, har de dog en lidt højere risiko for at udvikle lymfom i løbet af deres liv. I virusreplikation er provirus integreret i cellegenomet i hver inficeret celle, så tumorinduktion kan forekomme. Men da signifikant færre kropsceller er påvirket af en regressiv infektion end hos en gradvis inficeret kat med vedvarende virusreplikation, er risikoen for ondartet degeneration af værtsceller lavere. Lymfomer udvikler sig normalt kun hos regressivt inficerede dyr i en signifikant ældre alder, og der er en øget forekomst af B-celle lymfom.
Katte med regressiv infektion er immune over for reinfektion med FeLV. De har normalt høje niveauer af virusneutraliserende antistoffer i årevis, selvom de aldrig kommer i kontakt med virussen igen.
Fokal eller atypisk infektion
Fokal eller atypisk infektion er karakteriseret ved vedvarende virusreplikation, der er lokalt begrænset til visse væv. For eksempel kan individuelle brystkirtler, urinblæren eller slimhinderne i øjnene blive påvirket. Da virusreplikation kun finder sted i visse væv, er der normalt kun små mængder virus i blodet, og bevis for virusprotein er normalt kun svagt. I nogle tilfælde finder virusreplikationen kun sted intermitterende, så detektionen af det berørte dyr kun er positiv på bestemte tidspunkter. Virussen udskilles lokalt afhængigt af det berørte væv, ofte intermitterende og normalt i mindre mængder end hos akut viræmiske eller gradvis inficerede katte.
Efter eksperimentel infektion viser op til 10% af kattene et atypisk infektionsforløb, men det antages, at dette infektionsforløb forekommer sjældnere under naturlige forhold.
Da de berørte dyr kun har lokal eller intermitterende virusreplikation og dermed også udskillelse, er de ofte vanskelige at identificere diagnostisk, men repræsenterer en potentiel kilde til infektion for andre katte på grund af den intermitterende virusudskillelse.
Klinisk billede og symptomer
Navnet på virussen som felint leukæmivirus kom efter observationen, at katte inficeret med virussen ofte udvikler tumorer i de hvide blodlegemer, dvs. leukæmi . Imidlertid er de kliniske virkninger af FeLV-infektion ikke begrænset til udviklingen af tumorer i de hæmatopoietiske celler, og disse er heller ikke de mest almindelige sygdomme forbundet med FeLV-infektion. De mulige kliniske konsekvenser af en FeLV-infektion er ekstremt forskellige, især da infektionen ofte forårsager en immundefekt, der kan føre til ikke-specifikke sekundære infektioner. Feline leukæmi-virus er ansvarlig for flere forskellige kliniske symptomer og syndromer hos katte end noget andet kendt enkeltpatogen. De mest almindelige kliniske konsekvenser af FeLV-infektion er immundefekt, anæmi og lymfom.
Spørgsmålet om, hvilke symptomer der opstår i løbet af infektionen, bestemmes på den ene side af egenskaberne af virusstammen, der forårsager infektionen, og på den anden side af egenskaberne for det inficerede dyr. Infektioner med vira af FeLV-B-undertypen er forbundet med udvikling af tumorer, mens infektioner med FeLV-C-undertypen udløser en ikke-regenerativ anæmi.
Kliniske symptomer forekommer hovedsageligt hos progressivt inficerede katte, da nye kropsceller konstant inficeres af den vedvarende virusreplikation. Til sammenligning har regressivt inficerede katte en signifikant lavere risiko for at udvikle kliniske symptomer, som normalt kun vises efter en signifikant længere ventetid.
Klinisk skelnes der mellem neoplastiske sygdomme, der er forbundet med dannelsen af forskellige tumorændringer, og ikke-neoplastiske sygdomme. De ikke-neoplastiske FeLV-associerede sygdomme og syndromer inkluderer patologiske ændringer i blodlegemer, immundefekt, immunmedierede sygdomme og andre syndromer og symptomkomplekser, såsom neuropatier eller reproduktionsforstyrrelser.
FeLV-associerede neoplasmer
Den neoplastiske form er karakteriseret ved udvikling af tumorer. FeLV-infektion forårsager hovedsageligt lymfomer og leukæmi og mindre ofte andre tumorer i det hæmatopoietiske system. Andre ondartede tumorer såsom B. neuroblastomer eller osteochondromas .
Onkogenese ved FeLV
Efter infektion af en værtscelle med FeLV integreres en DNA-kopi af virusgenomet i værtscellens genom. Denne indsættelse forekommer tilfældigt forskellige steder i værtsgenomet. Afhængigt af hvor i genomet virus-DNA'et indsættes, kan der forekomme ændringer i ekspressionen af forskellige gener i værtscellen. Hvis et proto-onkogen påvirkes, kan dette føre til en ondartet degeneration af værtscellen, som videregiver den genetiske information inklusive FeLV-genomet til dattercellerne, der dannes under celledeling.
Protooncogener er gener, hvis transkriptionsprodukter spiller en vigtig rolle i regulering af cellevækst, celledeling og celledifferentiering. De koder for eksempel for vækstfaktorer , vækstfaktorreceptorer eller proteinkinaser , som, når de udtrykkes på en ukontrolleret måde, fremmer celleproliferation . Deres udtryk er underlagt finjusterede genetiske kontrolmekanismer. Er disse mekanismer z. B. tabt gennem en mutation, er der en ukontrolleret ekspression af proto-onkogenet, hvilket resulterer i ukontrolleret cellevækst eller ændringer i celledifferentiering.
I replikationscyklussen for FeLV integreres virussnissen i værtscellets genom. Hvis dette sker i umiddelbar nærhed af et cellulært proto-onkogen, overtager den virale promotor reguleringen af ekspressionen af dette gen og stimulerer det til konstant ekspression, hvilket kan føre til ukontrolleret celleproliferation og dermed udvikling af en tumor.
En anden mekanisme til tumorinduktion ved FeLV er tabet af et tumorundertrykkende gen gennem indsættelsen af virusgenomet. Dette eliminerer en genetisk kontrolmekanisme, der hæmmer genekspression, hvilket også fører til ukontrolleret ekspression af det tidligere kontrollerede onkogen. Denne mekanisme forekommer dog sjældnere, da to alleler af et gen er til stede i cellen, og begge suppressorgener skal svigte, før deres funktion går tabt.
En rekombination mellem FeLV-genomet og det cellulære DNA i værtscellen kan føre til dannelsen af rekombinante vira. Cellulære onkogener kan også integreres i virusgenomet, som derefter integreres i deres cellegenom, når andre værtsceller inficeres. Da placeringen af indsættelsen bestemmes tilfældigt, er det nyindsatte onkogen ikke længere underlagt den fysiologiske kontrol af den tilknyttede transkriptionsenhed, hvilket fører til en ukontrolleret transkription af genproduktet, hvilket kan resultere i en ondartet transformation af den tilsvarende vært celle.
Rekombinante vira kan ofte isoleres fra feline lymfomceller , der er opstået ved en rekombination mellem FeLV-virusgenomet og Myc-onkogenet i værtscellen. Disse rekombinante vira omtales følgelig som FeLV / myc . myc koder for forskellige transkriptionsfaktorer , så det spiller en vigtig rolle i kontrollen af genekspression . 10% til 15% af FeLV-associerede lymfomer indeholder myc-transducerende virus, og i thymiske lymfomer er det næsten 30%.
En anden rekombinant virus, der ofte isoleres fra feline lymfomer, er FeLV / tcr , hvilket skyldes rekombination med genet for den cellulære T-celle-receptor . T-cellereceptorer er forankret på overfladen af lymfoide celler og spiller en vigtig rolle i genkendelsen af antigener og reguleringen af immunresponset. Deres aktivering fører til ændringer i celledifferentiering og genekspression. Efter overførslen af tcr-genet af det rekombinante FeLV / tcr til genomet i en værtscelle, kan T-celle-receptoren overudtrykkes med øget celleproliferation på grund af autokrin stimulering og dermed ondartet degeneration af cellen.
Vedvarende viremiske katte inficeres konstant med andre kropsceller, som hver især er forbundet med en integration af virusgenomet i værtscellens genom. Sandsynligheden for ondartet degeneration på grund af en insertionsmutation eller på grund af en rekombination mellem virusgenomet og cellulære onkogener stiger således alt efter antallet af nyinficerede celler. I tumorcellerne fra de fleste FeLV-associerede lymfomer er der flere forskellige genetiske læsioner induceret af virussen, som normalt påvirker mere end et genlokus. Indtil videre kunne i genomet af lymfomceller fra FeLV-inficerede katte identificeres 12 steder på 6 forskellige genplaceringer, hvor virus-DNA blev integreret.
Feline sarcoma virus (FeSV) er et specielt tilfælde af rekombination mellem FeLV og cellulære gensegmenter Dette forekommer de novo hos FeLV-inficerede katte gennem rekombination med cellulære onkogener. Da en stor del af virusgenomet erstattes af cellulære onkogener, er FeSV replikationsdefekt og er afhængig af FeLV-A som hjælpevirus til reproduktion .
Lymfom
Lymfom er den mest almindelige ondartede tumor hos huskatte verden over. I 1980'erne blev op til 80% af lymfomer diagnosticeret hos katte direkte tilskrevet FeLV-infektion. Siden da er andelen af FeLV-associerede lymfomer i det samlede antal diagnosticerede lymfomer faldet markant. I dag er kun omkring 13-15% af lymfomer diagnosticeret hos katte relateret til FeLV-infektion, hvilket skyldes den kraftigt lavere forekomst af FeLV-infektion i kattepopulationen. Interessant er imidlertid denne udvikling ikke forbundet med et fald i den samlede forekomst af felint lymfom.
60% til 80% af FeLV-inficerede katte, der udvikler lymfom, er gradvis inficeret og har derfor vedvarende viræmi. Hos unge katte under et år diagnosticeret med lymfom viser så meget som 90% FeLV-viræmi, mens det hos ældre katte over 7 år kun er 50%.
Katte, der gradvis er inficeret med FeLV, er 60 gange mere tilbøjelige til at udvikle lymfom eller leukæmi end katte, der aldrig har haft kontakt med virussen. De mest almindelige er T-celle lymfomer . Mediastinal eller thymiske lymfomer er ofte forbundet med FeLV-infektion, især hos unge katte under 3 år . Fordøjelses- eller gastrointestinale lymfomer observeres derimod hovedsageligt hos ældre katte og kan normalt ikke tilskrives FeLV-infektion. Selv spinalformer diagnosticeres regelmæssigt.
De generelle tegn på lymfom er ikke-specifikke og inkluderer sløvhed (sløvhed), appetitløshed (anoreksi) og vægttab. De andre symptomer afhænger af det berørte organsystem. I fordøjelseslymfomer kan tyndtarmen, tillægget og tyktarmen påvirkes, dyrene viser hovedsagelig opkastning og diarré. I den multicentriske form er der en generaliseret sygdom i lymfeknuderne (lymfoadenopati), lymfosarkomer i nyrerne og forstørrelse af milten og / eller leveren forekommer også. I thymusformen kan synkesygdomme (dysfagi) og åndenød (dyspnø) på grund af kompression af spiserøret og luftrøret forekomme på grund af den tumorforstørrelse af organet. Ofte kan neoplastiske celler påvises i pleuravæsken.
I lymfoide-leukæmisk form påvirkes knoglemarven primært; degenererede lymfocytter cirkulerer i blodet (leukæmi). De vigtigste symptomer er svaghed, anoreksi, gulsot, feber, anæmi og bleg slimhinder. Derudover kan sygdomme i lymfeknuderne, miltforstørrelse (splenomegali) og leverforstørrelse (hepatomegali) forekomme.
Leukemias
Leukæmi er en ondartet sygdom i det bloddannende eller lymfesystem. I princippet er alle hæmatopoietiske celler modtagelige for FeLV-infektion, så lymfatiske såvel som myeloide leukæmier ( granulocytisk , erytroisk og megakaryocytisk ) kan forekomme i forbindelse med FeLV-infektion. Hvis FeLV-infektion opstår på stamcelleniveau , kan mere end en række celler blive påvirket.
FeLV-infektion kan påvises hos ca. 50% af katte, der er diagnosticeret med leukæmi.
FeSV-inducerede tumorer
Fibrosarkomer induceret af felinsarkomvirus (FeSV) repræsenterer et specielt tilfælde af FeLV-associerede tumorer . FeSV opstår de novo hos katte inficeret med FeLV-A gennem en rekombination af FeLV-A med protoonkogener af værtscellen. Det har en replikationsfejl, hvorfor det afhænger af tilstedeværelsen af FeLV-A som hjælpevirus for at være i stand til at inficere andre kropsceller. Dette betyder, at FeSV-associerede fibrosarkomer kun kan udvikle sig, hvis der er en samtidig FeLV-A-infektion med vedvarende viræmi.
På grund af replikationsdefekten kan Feline Sarcoma Virus ikke overføres vandret fra kat til kat. Så bæredyr af FeSV er ikke en kilde til infektion for andre katte.
Da FeSV integrerer protooncogener i værtscellens genom under hver replikationscyklus, inducerer den ukontrolleret proliferation i de inficerede celler og har således akutte tumorinducerende egenskaber. Efter kun en kort inkubationsperiode udvikler de berørte dyr polyklonale fibrosarkomer med en lav grad af differentiering , som forekommer samtidigt eller med korte intervaller i forskellige dele af kroppen og organerne. De forekommer primært som flere hud- og subkutane knuder hos unge katte og er tilbøjelige til hurtig og invasiv vækst og metastase til lungerne og andre organer.
FeLV-associerede ikke-neoplastiske sygdomme og symptomer
Ændringer i blodlegemer

Hæmatologiske ændringer, der er beskrevet i forbindelse med FeLV-infektion, er primært baseret på en forstyrrelse af dannelsen af blodlegemer i knoglemarven ( myelosuppression ). De inkluderer ikke-regenerativ og regenerativ anæmi, vedvarende, forbigående eller cyklisk neutropeni , patologiske ændringer i blodplader ( trombocytopenier og abnormiteter i blodpladefunktion), aplastisk anæmi ( pancytopeni ) og syndromer, der ligner panleukopeni .
De patologiske mekanismer, hvormed FeLV forårsager knoglemarvsundertrykkelse, er endnu ikke helt forstået. På den ene side forårsager inkorporeringen af FeLV-provirus i cellens egne gensekvenser desintegration og dermed inaktivering af gener. På den anden side kan ekspressionen af nærliggende gensekvenser også ændres af det virale DNA. Myelomonocyte progenitorceller og stromale fibroblaster , som spiller en vigtig rolle i mikromiljøet af knoglemarven, kan blive forstyrret i deres funktion efter infektion med FeLV og den tilhørende provirus DNA, hvilket fører til forstyrrelser i homeostase i knoglemarven. Derudover kan FeLV-infektion inducere ekspression af antigener på celleoverfladen af stamceller, hvilket fører til immunmedieret ødelæggelse af cellerne.
Anæmi forekommer hos mere end 50% af FeLV-inficerede og syge katte. Kun ca. 10% af FeLV-associerede anæmi er regenerative, mens langt størstedelen af dem er ikke-regenerative. Den vigtigste patomekanisme i udviklingen af FeLV-associeret anæmi er den direkte infektion af de hæmatopoietiske stamceller og de stromale celler, som er ansvarlige for miljøet omkring de hæmatopoietiske celler. Derudover kan andre faktorer forårsage ikke-regenerativ anæmi hos FeLV-inficerede katte. De kroniske infektioner forårsaget af infektionen kan føre til høje cytokinniveauer , som i sidste ende fører til anæmi. I FeLV-associerede leukæmier kan de prolifererende tumorceller i knoglemarv fortrænge de andre forløberceller, og dermed undertrykker dannelsen af røde blodlegemer ( engelsk trænger ud ).
Især infektionen med FeLV-C-undertypen forårsager massiv knoglemarvsdepression gennem en afbrydelse af celledeling, hvilket fører til svær aregenerativ anæmi, den såkaldte rene røde blodlegemer aplasi . Makrocytose af erytrocytterne med samtidig fravær af reticulocytter kan observeres hos de berørte dyr . I et avanceret stadium af FeLV-C-infektion lider dyrene ofte af aregenerativ pancytopeni.
Mange progressivt FeLV-inficerede katte har et reduceret antal blodplader ( trombocytopeni ), hvilket, afhængigt af omfanget, fører til en øget tendens til blødning. Trombocytopeni kan være forårsaget af nedsat blodpladeproduktion på grund af infektion i blodpladeforløberceller ( megakaryocytter ) eller leukæmisk infiltration af knoglemarven. På den anden side kan immunmedieret ødelæggelse med forkortet blodpladers overlevelsestid forekomme, hvilket ofte er forbundet med immunmedieret hæmolytisk anæmi. Ud over et reduceret antal blodplader kan der også forekomme en forstyrrelse af blodpladefunktionen .
Ud over ændringer i antallet af røde blod og blodplader kan FeLV-infektionen også føre til lidelser i antallet af hvide blodlegemer. For eksempel diagnosticeres ofte et fald i neutrofile granulocytter hos FeLV-inficerede dyr . I nogle tilfælde kan hypoplasi i alle granulocytfaser observeres, hvilket sandsynligvis skyldes en infektion i neutrofile stamceller. Da neutrofiltallet i nogle tilfælde genopretter efter administration af glukokortikoider, diskuteres også en immunmedieret mekanisme i udviklingen af neutropeni.
Hos mange vedvarende viræmiske katte viser neutrofilerne også nedsat kemotaksi og nedsat fagocytosefunktion , så der ud over den rene reduktion i antallet af celler også er en funktionel lidelse.
Neutropeni kan forekomme isoleret eller i forbindelse med et nedsat antal lymfocytter . FeLV kan replikere direkte i lymfocytterne. Normalt påvirkes både T-hjælpercellen og de cytotoksiske T-celler af lymfopenien; imidlertid observeres også et forøget tab af CD4- positive T-hjælperceller, således at der er en vending af CD4 + / CD8 + -forholdet.
Det kattepanleukopeni-lignende syndrom (FPLS) , som også er under navnet FeLV-associeret Enetritis eller Myeloblastopenie, er kendt ved en alvorlig leukopeni (<3000 celler / mm), en enteritis i og ødelæggelse af epitelet i tarmkrypterne. Symptomerne ligner dem fra Feline panleukopenia virus (FPV) forårsaget af feline panleukopeni og udtrykker sig i blodig diarré, opkastning, sår i mundslimhinden, tyggegummibetændelse, appetitløshed og vægttab. Det er uklart, om dette syndrom er forårsaget direkte af FeLV-infektionen, eller om det er co-infektion med FPV.
Svækkelse af immunsystemet og sekundære infektioner
Uanset om dyrene viser kliniske symptomer på FeLV-infektion, er hver kat med vedvarende FeLV-viræmi immunkompromitteret og lider af et forsinket og reduceret primært såvel som sekundært immunrespons.
Mekanismerne bag FeLV-associeret immundefekt er meget komplekse og varierede. De hyppigt forekommende ændringer i det hvide blodtal, såsom neutropeni, lymfopeni, neutrofil dysfunktion, tab af CD4-positive T-celler og / eller CD8-positive lymfocytter fører til en svækkelse af både det cellulære og det humorale immunrespons . Dette resulterer i en nedsat evne hos de inficerede dyr til at reagere immunologisk tilstrækkeligt på infektioner og andre skadelige stoffer .
Mange FeLV-inficerede katte viser også ændringer i cytokinproduktionen . De forskellige cytokiner spiller en vigtig rolle i koordineringen af det immunologiske respons. Ændringer i deres interaktion fører derfor til forstyrrelser i det immunologiske forsvar, hvilket kan resultere i både et fald og en overdreven immunologisk reaktion. Mens nogle katte viser reduceret interleukin-2 og interleukin-4 niveauer, påvirkes interleukin-1- produktion ikke af FeLV-infektion. Sammenlignet med raske katte producerer T-celler fra inficerede katte signifikant mindre B-celle-stimulerende faktor (interleukin-6) . Niveauet af interferon-y kan nedsættes eller øges. Et øget niveau af tumornekrosefaktor-α (TNF-α) detekteres også ofte i serum fra inficerede katte . Disse ændringer i cytokinkoncentrationer kan bidrage til en dysregulering af immunsystemet.
Svækkelsen af immunsystemet er den mest almindelige og vigtigste kliniske konsekvens af FeLV-infektion. Det er ansvarligt for langt størstedelen af FeLV-associerede symptomer og fører ofte til sekundære infektioner, der kræver behandling med bakterielle, virale og protozoale patogener samt svampeinfektioner.
På grund af immunmangel kan disse infektioner forårsage mere alvorlige symptomer end hos raske katte. Disse inkluderer B. Infektioner med Mycoplasma haemofelis eller Cryptococci . Infektioner, der normalt er symptomfrie hos raske katte, såsom infektion med Toxoplasma gondii , kan forårsage alvorlige symptomer hos immunkompromitterede FeLV-inficerede katte. Derudover infektioner med opportunistiske patogener såsom B. Salmonella , som ikke kunne forårsage infektion hos raske katte. Behandling af den sekundære infektion er ofte længere og kræver mere aggressiv behandling end hos raske katte.
En anden konsekvens af svækkelsen af immunresponset er et reduceret tumorforsvar, således at progressivt inficerede katte har en øget risiko for at udvikle tumorer, der ikke direkte induceres af FeLV-virussen.
Immunmedierede sygdomme
Selvom det humorale immunrespons på specifik stimulering falder i løbet af en FeLV-infektion, viser nogle FeLV-inficerede katte også uspecifikt forhøjede niveauer af immunglobulin G (IgG) og immunglobulin M (IgM) . Den immunologiske dysregulering associeret med FeLV-infektion, især afbrydelsen af T-suppressorcelleaktivitet, kan føre til en overdreven antistofrespons på de kronisk vedvarende infektioner. Da de dannede antistoffer ikke kan neutraliseres, dannes der antigen-antistofkomplekser , som aflejres i det smalle kapillærleje og fører til vaskulær betændelse der. Som en klinisk konsekvens kan glomerulonephritis , polyarthritis eller uveitis med aflejringer af immunkomplekser i iris og ciliære legemer forekomme. Immunmedieret hæmolytisk anæmi (IHA) er også mindre almindelig.
Stomatitis
Kronisk ulcerøs-proliferativ gingivostomatitis kan udvikle sig hos nogle inficerede katte . Histologisk kan immigrerede plasmaceller og lymfocytter påvises i slimhinden ledsaget af neutrofil og eosinofil inflammation i varierende grad . Læsionerne er meget smertefulde, hvorfor de berørte dyr ofte nægter at spise og tabe sig. Ofte er der også tab af tænder.
Årsagerne til FeLV-associeret gingivostomatitis er uklare. Også her antyder de histologiske fund inddragelse af en overdreven immunrespons på den kroniske antigenstimulering eller en immunologisk dysregulering. En mere eller mindre stærk involvering af sekundære infektioner såsom B. med calicivirus anses for sandsynligt.
Neuropatier
FeLV-inficerede katte kan udvikle neurologiske symptomer, hvoraf de fleste er et resultat af lymfom eller lymfocytisk infiltration af hjernen eller rygmarven, hvilket forårsager kompression af det omgivende væv. Da neurologiske symptomer også blev observeret hos katte, hvor der ikke kunne påvises tumorforandringer i centralnervesystemet i et senere afsnit , antages det, at FeLV også kan udvikle en direkte neurotoksisk effekt i tilfælde af infektioner i nerveceller. Det er blevet vist, at glycoproteiner i viruskappen kan øge det intracellulære niveau af frit calcium i nervecellerne, hvilket fører til neuronal celledød. Degenerative ændringer i det hvide stof med en udvidelse af myelinskederne samt hævede axoner i området af rygmarven og hjernestammen kunne påvises mikroskopisk.
De mest almindeligt beskrevne neurologiske symptomer inkluderer unormale vokaliseringer, hyperæstesi og parese, der forværres til lammelsespunktet . Nogle katte har anisocoria , mydriasis , central blindhed eller Horners syndrom ; andre har urininkontinens . Normalt starter symptomer mildt og bliver gradvist værre, når sygdommen skrider frem.
Fertilitetsforstyrrelser
Hos drægtige katte fører FelV viræmi til embryonal fosterdød, dødfødsler eller fødsel af viræmiske killinger, der tager sig af og dør efter kort tid ( falmende killingsyndrom ). Virussen overføres normalt ikke til killingerne af regressivt inficerede katte, men det er muligt, at individuelle killinger i et kuld senere udvikler viræmi. I disse tilfælde opstår infektionen gennem modermælk fra individuelle brystkomplekser, hvor virussen kan fortsætte. Ved at aktivere kirtelvævet mod slutningen af graviditeten kan virusreplikation genaktiveres, så infektiøse vira udskilles i modermælken i det berørte brystkompleks.
diagnose
Bekræftelsesprocedure
Forskellige metoder er tilgængelige til diagnostisk påvisning af FeLV-infektion. Ud over påvisningen af virusprotein kan polymerasekædereaktionen anvendes til at detektere både viralt DNA og viralt RNA i blodprøver eller i knoglemarven. Et immunfluorescensassay (IFA) og antistofdetektion er også tilgængelige. Når man fortolker de resultater, der er opnået ved de forskellige metoder, skal det altid tages i betragtning, at FeLV-infektionen kan antage meget forskellige former, og at endda regressivt inficerede katte ikke helt kan eliminere virussen fra kroppen.
| Infektionsforløb | p27-antigenpåvisning fra blod | viral RNA-PCR fra blod | proviral DNA-PCR fra blod | Virus udgydelse | Udvikling af FeLV-associerede sygdomme |
|---|---|---|---|---|---|
| progressiv infektion | positiv | positiv | positiv | positiv | sandsynligvis |
| regressiv infektion | negativ eller forbigående | negativ eller forbigående | positiv | negativ | usandsynlig |
| abortinfektion | negativ | negativ | negativ | negativ | usandsynlig |
| fokal infektion | negativ | negativ | negativ eller positiv | variabel | usandsynlig |
Da positive beviser for FeLV-infektion kan have konsekvenser med hensyn til opbevaring af de berørte katte (behov for adskillelse) såvel som til behandling af kliniske sygdomme op til beslutningen om eutanasi, bør hvert positive resultat af en screening udføres - Test bekræftes ved gentagelse af en test. Dette gælder især for klinisk iøjnefaldende dyr, hvis anamnese kun antyder en lav risiko for infektion, da sandsynligheden for falske positive testresultater er høj her.
Isolering af felint leukæmivirus, der udføres ved hjælp af en cellekultur, betragtes som den diagnostiske gyldne standard. Isolationen kan finde sted fra inficerede celler i blodet eller vævsprøverne. Denne metode anvendes hovedsageligt i videnskabelige undersøgelser til påvisning af FeLV-infektion, men på grund af den høje involverede indsats anvendes denne test ikke til rutinemæssig veterinærdiagnostik.
Til diagnosticering af FeLV-infektion anvendes påvisning af det opløselige virale kapsidprotein p27 i blodet ved hjælp af en ELISA rutinemæssigt som en screeningstest (såkaldt p27-antigen test). Hurtige tests fra forskellige producenter er tilgængelige til brug i veterinærpraksis til denne undersøgelse. Alle laboratorier med speciale i veterinærmedicin tilbyder også påvisning af p27-antigenet fra blodprøver. I princippet kan p27-antigenet også påvises i spyt eller tårevæske. Men da virussen kun udskilles intermitterende hos nogle dyr, foretrækkes det at teste en blodprøve.
I områder med lav prævalens er den informative værdi af et positivt testresultat lavere, med de fleste testsystemer er den positive forudsigelsesværdi omkring 80%. Derfor bør enhver positiv test kontrolleres. På grund af screeningstesternes høje følsomhed og den generelle lave prævalens af FeLV-infektion kan negative testresultater imidlertid betragtes som meget pålidelige (høj negativ forudsigelsesværdi ).
Påvisningen af p27-antigenet korrelerer godt med tilstedeværelsen af en viræmi. De fleste katte, der bliver inficeret med FeLV, vil reagere positivt på antigenpåvisning inden for 2 til 3 uger efter infektion. I tilfælde af en regressiv infektion bliver dyrene negative for p27 inden for 2 til 8 uger mere, i sjældne tilfælde kan dette tage måneder. Hos progressivt inficerede katte kan virusantigen findes i blodet selv længe efter infektion. En positiv test bør derfor gentages efter ca. 6 uger for at kunne skelne mellem en regressiv og en progressiv infektion. I tilfælde af et andet positivt resultat kan en tredje test udføres efter yderligere 10 uger. Dyr, der stadig reagerer positivt, er meget sandsynligt vedvarende viræmiske.
Cellebundet DNA (provirus) kan påvises i blodprøver, knoglemarvsbiopsier og aspirater samt vævsprøver via en polymerasekædereaktion . Regressivt inficerede katte reagerer negativt i p27-antigenpåvisningen, da der ikke finder nogen virusreplikation sted i dem, og derfor cirkulerer intet viralt protein i blodet. Hos disse dyr kan FeLV-provirus-DNA imidlertid påvises i blodcellerne ved hjælp af PCR.
PCR kan også bruges til at detektere viralt RNA i prøver fra inficerede katte. Fuldblod, serum , plasma , spyt eller afføring kan bruges som testmateriale. Denne metode kan også bruges til at detektere og kvantificere gratis virus, der ikke er bundet til værtscellen. Resultaterne af DNA-PCR og RNA-PCR behøver ikke altid at matche, så mange katte, der har været i stand til at overvinde en viræmi, reagerer negativt i p27-påvisningen og i RNA-PCR, da der ikke længere er virus i blodet. Da FeLV-genomet blev integreret i genomet af inficerede værtsceller som et provirus, var DNA-PCR imidlertid positivt.
Granulocytter, lymfocytter og blodplader fra viræmiske katte indeholder Gag-proteinet. Dette kan påvises i udstrygninger fra blodet eller knoglemarven ved hjælp af en indirekte immunfluorescens test (IFA) . Selvom denne metode giver en relativt lav følsomhed, er det også meget sandsynligt, at katte, der reagerer positivt på IFA, har viræmi. Imidlertid kan IFA være falsk negativ på trods tilstedeværelsen af viræmi hos katte med leukopeni eller hvor kun nogle af de perifere leukocytter er inficeret.
IFA reagerer kun positivt efter infektionen i knoglemarven og under den anden viræmi, da først derefter bindes virussen bundet til blodcellerne i blodbanen. Da dette er et avanceret stadium af infektionen, er det usandsynligt, at katte, der tester positive ved IFA, senere vil reagere negativt, fordi de har udviklet en regressiv infektion.
Immunkompetente katte udvikler høje niveauer af antistoffer for livet efter overlevende viræmi. Men da mange dyr også producerer antistoffer mod endogent FeLV i kattegenomet, har påvisning af antistoffer til diagnosen FeLV-infektion indtil videre kun været af begrænset anvendelse. Imidlertid er der nu udviklet en testmetode til påvisning af antistoffer mod p15 (E) -proteinet, hvormed antistoffer, der er dannet på grund af en eksisterende FeLV-infektion, kan differentieres pålideligt fra antistoffer mod endogent FeLV. Denne metode er dog endnu ikke blevet brugt i rutinemæssig diagnostik.
Som regel testes individuelle dyr ved hjælp af de forskellige tilgængelige testmetoder. Til screeningstest i større grupper af katte, såsom omstrejfende grupper, dyrehjem eller husholdninger med flere katte, kan prøver samles til en RNA-PCR-test. RNA-PCR er så følsom, at en enkelt inficeret kat kan påvises i en pulje med op til 30 prøver.
Differential diagnose
Da FeLV-infektionen i sig selv er forbundet med et stort antal symptomer, og den inducerede immundefekt også favoriserer adskillige forskellige sekundære infektioner, er det mulige kliniske billede ekstremt variabelt. De inducerede tumorer forårsager forskellige symptomer afhængigt af deres placering. Af denne grund har diagnostisk oparbejdning og differentieret diagnose af FeLV-infektion en særlig position. Afhængig af de tilstedeværende symptomer skal andre neoplastiske sygdomme, immununderskudssyndrom hos katte (FIV-infektion, kattehjælpemidler) , katteinfektiøs peritonitis (FIP), katteinfektiøs anæmi (hæmobartonellose) og andre infektiøse sygdomme udelukkes.
Det anbefales generelt, at alle katte med symptomer, der kan være relateret til FeLV-infektion, testes for p27-antigen. Dette gælder også for syge katte, for hvem der for lang tid siden blev udført en test for FeLV med negative resultater, hvis det ikke med sikkerhed kan udelukkes, at der har været kontakt med virussen i mellemtiden. Selv i tilfælde af symptomer, hvor en infektion kan bevises at være årsagen, skal det tages i betragtning, at en FeLV-infektion med ledsagende immundefekt er til stede på samme tid og kan fremme udviklingen af andre infektioner. Især katte med tilbagevendende bylder i det subkutane væv eller betændelser i mundhulen bør derfor testes for tilstedeværelsen af FeLV-infektion.
terapi
Den ene er ingen terapi, der fuldstændigt kan fjerne virussen fra kroppen i en gradvis inficeret kat. Selv med regressivt inficerede katte, der bærer proviruses i deres kropsceller, kan virussen ikke fjernes fra kroppen. Af denne grund er der ingen årsagsterapi for FeLV-infektion. Behandling af syge FeLV-inficerede katte er derfor primært rettet mod symptomatisk behandling af de symptomer, der forekommer i hvert enkelt tilfælde med det formål at forsøge at lindre dyrenes lidelse ( palliativ terapi ).
Mulighederne for antiviral kemoterapi får øget opmærksomhed inden for veterinærmedicin, men deres anvendelse er endnu ikke udbredt. Med forskellige aktive ingredienser anvendt i human medicin, især til HIV-behandling, var det muligt at hæmme FeLV-replikation hos katte. Med den aktive ingrediens azidothymidin (AZT) anvendt i human medicin mod retrovira kunne virusbelastningen i plasmaet hos katte reduceres, og både den immunologiske og kliniske tilstand forbedres, så en forbedring af livskvaliteten og en forlængelse af forventet levetid blev opnået var. Administration af den aktive ingrediens raltegravir inhiberede også virusreplikation, således at denne terapi opnåede en signifikant reduktion i virusbelastningen i blodet inden for en uge. Imidlertid lykkes ingen af disse midler fuldstændigt at undertrykke vedvarende viræmi. De aktive ingredienser skal derfor administreres over en længere periode for at opnå en lav virusbelastning på lang sigt og for at forhindre eller forsinke begyndelsen af kliniske symptomer. Selvom stofferne ofte tolereres godt af katte, er langvarig brug ofte forbundet med betydelige bivirkninger.
Katte diagnosticeret med progressiv FeLV-infektion med vedvarende viræmi, men uden kliniske symptomer, kræver ikke lægemiddelbehandling. De bør dog holdes strengt som indekatte, da dette kan reducere risikoen for sekundære infektioner. Samtidig er dette den eneste måde at forhindre dem i at inficere andre katte sikkert. Disse katte bør gives de sædvanlige rutinemæssige vaccinationer for at beskytte de immunkompromitterede dyr mod infektion. Det skal dog tages i betragtning, at disse dyr kan reagere på vaccinationen med et utilstrækkeligt immunrespons på grund af en muligvis eksisterende svækkelse af immunsystemet. Derfor er vaccinationsbeskyttelsen af FeLV-inficerede katte ikke komplet og kan ikke sammenlignes med den for raske dyr, så kortere vaccinationsintervaller end for raske dyr (f.eks. Hver 6. i stedet for hver 12. måned) bør overvejes. Generelt bør en inaktiveret vaccine foretrækkes frem for levende vacciner til disse dyr, da det med et svækket immunsystem ikke kan udelukkes, at selv de svækkede vaccinstammer kan udvikle patologisk potentiale.
Ejere af FeLV-positive katte bør også afstå fra at give uopvarmet mad, da dette medfører risiko for at overføre bakterielle eller parasitære infektioner. Sundhedsstatus for FeLV-inficerede asymptomatiske katte bør kontrolleres regelmæssigt. Det tilrådes derfor at foretage en blodtælling, en blodkemisk test og en urinanalyse udført hver 6. til 12. måned for at kunne identificere og behandle helbredsproblemer på et tidligt tidspunkt.
FeLV-inficerede katte, der viser symptomer på sygdom, bør gennemgå grundig diagnose og behandling med det samme for at muliggøre tidlig indgriben. Først og fremmest skal det afklares, hvilken sygdom der er den primære årsag til symptomerne. Ikke alle symptomer, der opstår, skal være direkte relateret til FeLV-infektionen. Omhyggelig og omfattende diagnostik er derfor vigtig for at kunne behandle den underliggende sygdom målrettet og konsekvent.
På grund af den mest eksisterende immunmangel er en længere eller mere aggressiv behandling ofte nødvendig end med FeLV-negative dyr, f.eks. B. i antibiotikabehandling. Kortikosteroider, andre immunsuppressiva eller lægemidler, der kan føre til knoglemarvsundertrykkelse, bør generelt ikke administreres undtagen til behandling af FeLV-associerede tumorer eller immunmedierede sygdomme.
Hos FeLV-positive katte, der lider af anæmi, skal årsagssagen først afklares. Immunmangel kan forårsage sekundære infektioner, der forårsager anæmi (fx Mycoplasma spp.). Hvis dette er tilfældet, skal disse infektioner behandles specifikt. Hvis anæmien er alvorlig, kan der udføres en blodtransfusion. Hvis anæmi er FeLV-induceret, kan behandling med glukokortikoider forsøges, fordi nogle af anæmierne forbundet med FeLV er immunmedierede, og disse katte reagerer godt på terapi. Glukokortikoider bør kun anvendes til FeLV-positive katte, hvis det er strengt indiceret, da den immunsuppressive effekt kan bidrage til en yderligere svækkelse af immunsystemet.
Til behandling af felint lymfom er der etablerede behandlingsprotokoller inden for veterinærmedicin ved hjælp af kemoterapeutiske lægemidler . COP-ordningen ( cyclophosphamid , vincristin , prednisolon ) og den aktive ingrediens chlorambucil har vist sig at være en succes . I nogle tilfælde reagerer tumorerne godt på behandlingen. Selvom kemoterapi ofte kan opnå remission af et lymfom, skal det være klart, at selv vellykket kemoterapi ikke har nogen indflydelse på vedvarende viræmi. Hos FeLV-positive katte er den mellemlang til langvarige prognose derfor mindre gunstig end hos FeLV-negative katte med ondartet lymfom.
Hos FeLV-inficerede katte med neurologiske symptomer skal årsagen til symptomerne først afklares. Ud over de direkte toksiske virkninger af FeLV-replikation kan de neurologiske symptomer også være baseret på et lymfom i CNS, sekundære infektioner (for eksempel med Cryptococcus ssp.) Eller toxoplasmose. Smitsomme sygdomme skal behandles direkte i dette tilfælde. Hvis der ikke kan bestemmes nogen anden årsagssygdom, og det antages, at de neurologiske symptomer er forårsaget direkte af FeLV, kan der udføres et behandlingsforsøg med det antivirale middel azidothymidin (AZT).
Hos FeLV-inficerede katte, der lider af tilbagevendende infektioner på grund af den immunmangel, der er forbundet med infektionen, skal disse infektioner behandles konsekvent for at sikre en god livskvalitet. Behandling med rekombinant felint interferon omega som en immunmodulator er mulig.
Vejrudsigt
Den prognose for vedvarende viræmiske katte skal generelt vurderes som ugunstig. I det overvældende flertal udvikler kliniske symptomer sig inden for måneder, og dyrene har en nedsat forventet levetid. Undersøgelser har vist, at omkring 50% af de gradvist inficerede katte dør inden for 2 år og 80% inden for 3 år efter diagnosen.
Imidlertid kan nogle katte leve ved godt helbred med vedvarende viræmi i mange år, før de udvikler symptomer. Dødsraten kan reduceres betydeligt gennem god pleje og vedligeholdelse af ejeren og boliger, hvilket kan reducere risikoen for sekundære sygdomme. Især kan den tidlige og konsistente behandling af sekundære infektioner bidrage til en forøgelse af forventet levetid med en god livskvalitet.
Beslutningen om at aflive eller behandle en FeLV-inficeret kat bør aldrig baseres på tilstedeværelsen af FeLV-infektion alene. Eutanasi er ikke indiceret til viræmiske men symptomløse katte, da det kan tage år for sygdommen at bryde ud. Det skal dog sikres strengt, at disse dyr ikke har kontakt med FeLV-negative dyr for at undgå transmission af virussen. Hvis en adskillelse ikke er mulig, f.eks. F.eks. I tilfælde af omstrejfende katte, der ikke kan være vant til eksklusiv bolig, bør eutanasi overvejes for at forhindre spredning af FeLV-infektion.
profylakse
vaccination
Vacciner mod FeLV har været kommercielt tilgængelige siden 1985. Adjuverede præparater fra inaktiveret virus, adjuverede præparater fra rekombinant virusoverfladeprotein og en adjuvansfri rekombinant vektorvaccine baseret på canarypox-virus er tilladt . Den opnåede vaccinationseffekt er baseret på en cellulær immunitet, der hurtigt fører til dannelsen af neutraliserende antistoffer, så snart katte kommer i kontakt med det naturligt forekommende FeLV-feltvirus. Når det primære vaccinationsforløb er afsluttet, tilbyder alle vacciner pålidelig beskyttelse mod udviklingen af vedvarende viræmi og udviklingen af kliniske symptomer på FeLV-infektion. Imidlertid inducerer ingen af de tilgængelige vacciner pålidelig steril immunitet, så infektion ikke forhindres, selv hos vaccinerede katte, hvilket sikkert kan overvinde dette takket være vaccinationsbeskyttelsen. Dette betyder, at selv hos vaccinerede katte efter kontakt med FeLV-provirus-DNA kan detekteres i blodet og for det meste også viralt RNA i plasmaet, men kun i en meget lav koncentration sammenlignet med vedvarende viræmiske katte, så de ikke er klinisk relevante, og disse katte kan betragtes som sikkert beskyttet mod udvikling af FeLV-associerede sygdomme med normalt infektionstryk.
Både de tysktalende nationale og internationale retningslinjer for vaccination af små dyr klassificerer vaccinationen mod felint leukæmivirus som en ikke-kernevaccination. Dette betyder, at FeLV-vaccination generelt ikke anbefales til hver kat, der skal vaccineres, men bør kun udføres efter afvejning af den individuelle infektionsrisiko. Vaccination anbefales til katte, der er i risiko for infektion, fordi de kan have kontakt med katte med en uforklarlig infektionsstatus. Dette er f.eks. B. for katte med fri adgang, til avls- og udstillingsdyr eller dyr, der er optaget i et dyrehospital, sagen. FeLV-vaccination bør kun undgås i tilfælde, hvor muligheden for eksponering for FeLV fuldstændigt kan udelukkes. Geografiske forskelle i FeLV-prævalens såvel som det faktum, at forholdene, hvor katten holdes, og dermed risikoen for FeLV-eksponering, ændrer sig over tid, f.eks. B. ved at flytte, bør overvejes, når man beslutter, om en kat skal vaccineres mod FeLV. Generelt giver FeLV-vaccinationen tilstrækkelig beskyttelse mod de potentielt fatale følger af en infektion, som skal afvejes mod den lave risiko for bivirkninger.
Unge katte kan vaccineres mod FeLV fra 8 uger. Til primær vaccination gives to injektioner med 3 til 4 ugers mellemrum. Med en ny injektion efter et år er den grundlæggende immunisering afsluttet. De fleste tilgængelige vacciner er godkendt til et års vaccinationsinterval. Da modtagelighed over for virussen falder med stigende alder, anses genvaccinationer hvert 2. til 3. år dog for tilstrækkeligt for katte ældre end 3 år efter en vellykket primærvaccination. Omvendt er unge katte særligt modtagelige for infektionen og har en højere risiko for at udvikle en progressiv infektion, hvorfor de skal være godt beskyttet af vaccination, især i de første par leveår.
For katte, hvis FeLV-vaccinationsstatus er ukendt, anbefales test for FeLV-antigen i blodet inden den første vaccination. Vaccination giver ikke mening for katte, der allerede var inficeret før vaccinationen, da vaccinationen ikke kan undertrykke en progressiv infektion og derfor ikke beskytter mod udviklingen af FeLV-associerede symptomer.
Undgå infektion
Ud over vaccination er undgåelse af infektion en vigtig profylaktisk foranstaltning, og progressivt inficerede katte bør være strengt adskilt fra uinficerede dyr. De skal opbevares som indekatte for at forhindre, at virussen spredes i nærheden. Opbevaring af katte separat og uden adgang beskytter FeLV-inficerede katte, der ofte lider af et svækket immunsystem, mod kontakt med smitsomme stoffer.
Hvis en kat i en husstand med flere katte tester positivt for FeLV, skal alle andre katte også testes. Alle dyr, der er testet positive, skal være strengt adskilt fra katte, der er testet negative for at forhindre yderligere spredning af infektionen. Vaccination af de negativt testede dyr giver en vis beskyttelse, men kan ikke garantere, at de vaccinerede dyr ikke udvikler en progressiv infektion, hvis der er et meget højt infektionstryk fra adskillige virustyrende dyr i umiddelbar nærhed.
Både mandlige og kvindelige gradvis inficerede katte bør kastreres for at minimere risikoen for virusoverførsel til andre dyr gennem territorial krigsførelse og parringsadfærd. Den kirurgiske indgriben ved kastrering tolereres normalt meget godt selv af progressivt inficerede dyr. Hvis standard hygiejnebestemmelserne overholdes, er der ingen risiko for, at infektionen overføres til andre dyr i veterinærpraksis.
Når der tilføjes nye katte med en ukendt FeLV-status til en eksisterende FeLV-negativ dyregruppe, f.eks. B. i dyrehjem, avlsdyr eller private husholdninger anbefales det oprindeligt at holde de nye dyr i karantæne i mindst 3 uger og derefter foretage en test for FeLV-antigen, før der er direkte kontakt mellem dyrene. Dyr, der reagerer negativt i antigentesten, bør holdes i karantæne, før testen skal gentages 6 uger senere, da det tager 4 til 6 uger for antigen at kunne påvises i blodet, efter at en infektion har fundet sted. Positive reagerende katte bør kun holdes i grupper med andre positivt testede dyr. Mange dyrehjem sørger for, at FeLV-positive katte holdes i isolation og uden kontakt med FeLV-negative katte. Ejere skal dog være grundigt informeret om infektionen og risiciene for andre katte, så kontakt med andre katte sikkert undgås. Det anbefales, at FeLV-positive katte aflives i dyrehjem.
Da direkte kontakt med udveksling af kropsvæsker, især spyt, er nødvendig til transmission, kan inficerede katte f.eks. B. i et dyrehospital eller ved et stationært ophold på en veterinærklinik opbevares i samme rum som ikke-inficerede katte, så længe der er direkte fysisk kontakt mellem dyrene, f.eks. B. forhindres af ophold i bure, og hygiejniske foranstaltninger tages i betragtning ved pleje af dyrene. Man skal dog være opmærksom på, at de FeLV-inficerede dyr ikke udsættes for en øget risiko for sekundære infektioner fra de andre dyr.
FeLV-infektionen kan også overføres gennem en blodtransfusion, hvorfor retningslinjerne for blodtransfusion hos katte indeholder en test af donordyret for FeLV-infektion. Da provirus-positive blodlegemer kan overføres under en blodtransfusion, anbefales en PCR-test for provirus-DNA, da regressivt inficerede dyr ikke kan identificeres ved en antigentest. Test bør udføres tidligst tre måneder efter sidste kontakt med en potentiel infektionskilde for at undgå falske negative resultater i den længere inkubationsperiode. I akutte livstruende nødsituationer, hvor ingen anden donor er tilgængelig i kort tid, skal risikoen for FeLV-transmission vejes op. I disse tilfælde skal der i det mindste udføres en hurtig test for p27-antigen. Ejeren af det modtagende dyr skal informeres om risikoen for overførsel.
Den feline leukæmivirus er relativt følsom og mister hurtigt sin infektivitet i miljøet . Det inaktiveres sikkert af alle almindelige desinfektionsmidler såvel som sæbeopløsninger . Af denne grund er overholdelse af generelle hygiejnestandarder inden for veterinærpraksis, dyrehjem og private husholdninger normalt tilstrækkelig til at undgå indirekte overførsel af virussen gennem forurenede genstande, såsom undersøgelses- og behandlingsinstrumenter, kirurgiske redskaber, madskåle eller endda hænder.
Weblinks
Individuelle beviser
- ↑ a b c d e f g h i j k l m n o p q r s K. Hartmann: 2.2. FeLV-associerede tumorer. I: Martin Kessler (red.): Onkologi til små dyr: diagnose og terapi af tumorsygdomme hos hunde og katte. 3. fuldstændig revideret og udvidet udgave. Enke-Verlag, Stuttgart 2012, ISBN 978-3-8263-3236-4 , s. 17-19.
- ↑ E. Dahme, E. Weiss: 2.5. Leukose. I: Oversigt over husdyrens specielle patologiske anatomi. 6., helt revideret udgave. Thieme Verlagsgruppe, Stuttgart 2006, ISBN 3-8304-1048-4 , doi: 10.1055 / b-002-8317 , s.44 .
- ↑ AW Philbey: Virus og kræft, katte og kvæg: en hyldest til Bill Jarrett. I: Veterinærjournalen. Bind 195, nr. 1, 2013, s. 2-3. PMID 23164956 , doi: 10.1016 / j.tvjl.2012.10.015
- ↑ a b c d e f g h i j k l m n o p q r Julia Beatty: Virale årsager til felint lymfom: Retrovirus og videre. I: Veterinærjournalen. Vol. 201, nr. 2, 2014 (Special: Feline Infectious Diseases.). Pp. 174-180. PMID 24928422 , doi: 10.1016 / j.tvjl.2014.05.026
- ^ WFH Jarrett, WB Martin, GW Crighton, RG Dalton, MF Stewart: Leukæmia in the Cat: Transmission Experiments with Leukæmia (Lymphosarcoma). I: Natur . Bind 202, 1964, s. 566-567. PMID 14195053 , doi: 10.1038 / 202566a0
- ↑ WFH Jarrett, EM Crawford, WB Martin, FA Davie: En viruslignende partikel forbundet med leukæmi (lymfosarkom). I: Natur. Bind 202, 1964, s. 567-569. PMID 14195054 , doi: 10.1038 / 202567a0
- ↑ C. Voisset, RA Weiss, DJ Griffiths: Human RNA "rygte" vira: søgningen efter nye humane retrovira i kronisk sygdom . I: Microbiol Mol Biol Rev . bånd 72 , nr. 1 , marts 2008, s. 157-196 , doi : 10.1128 / MMBR.00033-07 (engelsk).
- ↑ Robert Gallo: Jakten på virussen . S. Fischer-Verlag, 1991, ISBN 3-10-024404-4 , kap. 8. En enkelt sygdom med en enkelt årsag, s. 190 .
- ^ A b c Brian J. Willett, Margaret J. Hosie: Feline leukemia virus: Et halvt århundrede siden opdagelsen. I: Veterinærjournalen. Bind 195, 2013, s. 16-23. PMID 22867855 , doi: 10.1016 / j.tvjl.2012.07.004
- ↑ a b c d e f g h i K. Möstl, DD Addie, C. Boucraut-Baralon, H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, MJ Hosie, A. Lloret, H. Lutz, F. Marsilio, M. Grazia Pennisi, AD Radford, E. Thiry, U. Truyen, MC Horzinek: Noget gammelt, noget nyt - Opdatering af ABCD-retningslinjerne for 2009 og 2013 om forebyggelse og håndtering af infektionssygdomme hos katte. I: Journal of Feline Medicine and Surgery. Bind 17, nr. 7, 2015, s. 570-582. PMID 26101308 doi: 10.1177 / 1098612X15588448
- ^ A b S. J. O'Brien, JL Troyer, MA Brown, WE Johnson, A. Antunes, ME Roelke, J. Pecon-Slattery: Emerging Viruses in the Felidae: Shifting Paradigms. I: Virus. Nr. 4, 2012, s. 236-257. PMID 22470834 , doi: 10.3390 / v4020236
- ↑ ML Meli, V. Cattori, F. Martinez, G. Lopez, A. Vargas, MA Simon, I. Zorrilla, A. Munoz, F. Palomares, JV Lopez-Bao og andre: katteleukæmivirus og andre patogener som vigtige trusler mod overlevelsen af den kritisk truede iberiske los (Lynx pardinus). I: PLoS One. Nr. 4, 2009, vare e4744. PMID 19270739 , doi: 10.1371 / journal.pone.0004744
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af H. Lutz, D. Addie, S. Belák, C. Boucraut-Baralon , H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, MJ Hosie, A. Lloret, F. Marsilio, M. Grazia Pennisi, AD Radford, E. Thiry, U. Truyen, MC Horzinek: Feline Leukæmi: ABCD-retningslinjer for forebyggelse og styring. I: Journal of Feline Medicine and Surgery. Bind 11, nr. 07, 2009, s. 565-574. PMID 19481036 , doi: 10.1016 / j.jfms.2009.05.005
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am K. Hartmann: Clinical Aspects of Feline Retroviruses: En anmeldelse. I: Virus. Bind 4, nr. 4, 2012, s. 2684-2710. PMID 23202500 , doi: 10.3390 / v4112684
- ↑ a b c d e f g h i j k l J. Levy, C. Crawford, K. Hartmann, R. Hofmann-Lehmann RS Little, E. Sundahl, V. Thayer: 2008 American Association of Feline Practitioners 'feline retrovirus ledelsesretningslinjer. I: Journal of Feline Medicine and Surgery. Bind 10, nr. 3, 2008, s. 300-316. PMID 18455463 , doi: 10.1016 / j.jfms.2008.03.002
- ↑ a b c d e f g h i j k Thomas Vahlenkamp: 2.1. Virusassocieret onkogenese - kapitel 2.1.2. Retrovira. I: Martin Kessler (red.): Onkologi til små dyr: diagnose og terapi af tumorsygdomme hos hunde og katte. 3. fuldstændig revideret og udvidet udgave. Georg Thieme Verlag, 2012, ISBN 978-3-8263-3236-4 , s. 15-16.
- ↑ MC Horzinek, D. Addie, S. Belak, C. Boucraut-Baralon, H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, MJ Hosie, A. Lloret, H. Lutz, F. Marsilio , K. Möstl, M. Grazia Pennisi, AD Radford, E. Thiry, U. Truyen: ABCD - Opdatering af 2009-retningslinjerne om forebyggelse og styring af infektionssygdomme hos katte. I: Journal of Feline Medicine and Surgery. Bind 15, udgave 7, 2013, s. 530-539. PMID 23813810 , doi: 10.1177 / 1098612X13489208
- ↑ a b c d e K. Hartmann: Kliniske aspekter af felint immundefekt og infektion med katte leukæmi virus. I: Veterinærimmunologi og immunopatologi. Bind 143, nr. 3-4, 2011, s. 190-201. PMID 21807418 , doi: 10.1016 / j.vetimm.2011.06.003
- ↑ Tabel baseret på: Levy, C. Crawford, K. Hartmann, R. Hofmann-Lehmann, RS Little, E. Sundahl, V. Thayer: 2008 American Association of Feline Practitioners 'feline retrovirus management guidelines. I: Journal of Feline Medicine and Surgery. Bind 10, nr. 3, 2008, s. 300-316. PMID 18455463 , doi: 10.1016 / j.jfms.2008.03.002
- ↑ SN Ettinger: Principper for behandling af felint lymfom. I: Kliniske teknikker i praksis med små dyr. Bind 18, nr. 2, 2003, s. 98-102. PMID 12831069 , doi: 10.1053 / svms.2003.36623
- ↑ DA Grosenbaugh, V. Frances Duvert, S. Abedi, B. Feil Meier, H. Ru, H. Poulet: Effektivitet af en rekombinant ikke-adjuverede FeLV-vaccine og to inaktiverede FeLV-vacciner Når underlagt ensartet virulente FeLV tackling betingelser. I: Biologicals. Bind 49, 2017, s. 76-80. PMID 28734742 , doi: 10.1016 / j.biologs.2016.10.004
- ^ A b Standing Vet. Vaccination Commission ved Friedrich-Loeffler-Institut : Vaccinationsanbefaling til katte. I vejledningen til vaccination af små dyr. 4. udgave pr. 1. februar 2019 . S. 14, offentliggjort på hjemmesiden for Federal Association of Practicing Veterinarians (bpt), tilgængelig den 11. marts 2020.
- ↑ Den stående vaccinationskommission for den schweiziske sammenslutning for smådyremedicin : Vaccinationsanbefalinger fra SVK-ASMPA 2017. Udgave januar 2017, offentliggjort på hjemmesiden for den schweiziske sammenslutning for mindre dyremedicin SVK + ASMPA, tilgængelig den 27. marts 2018.
- ↑ Institut for Intern Medicin ved Klinikken for Små Dyr , Afdeling for Små Dyr og Heste ved Universitetet for Veterinærmedicin, Wien og det østrigske veterinærkammer: Retningslinjer for vaccination for små dyr 2017 fra maj 2017 . fra det østrigske veterinærkammer, adgang den 27. marts 2018.
- ↑ MJ Hosie, DD Addie, C. Boucraut-Baralon, H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, MC Horzinek, A. Lloret, H. Lutz, F. Marsilio, M. Grazia Pennisi , AD Radford, E. Thiry, U. Truyen, K. Möstl: Matrixvaccinationsretningslinjer - 2015 ABCD-anbefalinger til indendørs / udendørs katte, redningskatte og avlskatter. I: Journal of Feline Medicine and Surgery. Bind 17, 2015, s. 583-587. PMID 26101309 , doi: 10.1177 / 1098612X15590732
- ↑ MJ Day, MC Horzinek, RD Schultz, RA Squires: Retningslinjer for vaccination af hunde og katte udarbejdet af Vaccination Guidelines Group (VGG) fra World Small Animal Association (WSAVA). I: Journal of Small Animal Practice. Bind 57, nr. 1, 2016, s. E1-E45. PMID 26780853 , doi: 10.1111 / jsap.12431
- ^ A. Scherk, RB Ford, RM Gaskell, K. Hartmann, KF Hurley, MR Lappin, JK Levy, SE Little, SK Nordone, AH Sparkes: 2013 AAFP Feline Vaccination Advisory Panel Report. I: Journal of Feline Medicine and Surgery. Bind 15, nr. 9, 2013, s. 785-808. PMID 23966005 doi: 10.1177 / 1098612X13500429
- ^ M. Grazia Pennisi, K. Hartmann, DD Addie, H. Lutz, T. Gruffydd-Jones, C. Boucraut-Baralon, H. Egberink, T. Frymus, MC Horzinek, MJ Hosie, A. Lloret, F. Marsilio , AD Radford, E. Thiry, U. Truyen, K. Möstl: Blodtransfusion hos katte - ABCD-retningslinjer for minimering af risikoen for infektiøse iatrogene komplikationer. I: Journal of Feline Medicine and Surgery. Bind 17, 2015, s. 588-593. PMID 26101310 , doi: 10.1177 / 1098612X15588449










