Rhodopsin
| Rhodopsin | ||
|---|---|---|

| ||
| Tredimensionel strukturel model af rhodopsin- rygraden . 11-cis nethinden, som er vigtig for signalkaskaden, kan ses i midten (lysegrå) . Ifølge PDB 1L9H . | ||
| Egenskaber ved humant protein | ||
| Masse / længde primær struktur | 348 aminosyrer | |
| Sekundær til kvaternær struktur | multipass membranprotein | |
| Identifikator | ||
| Gen navn | RHO | |
| Eksterne ID'er | ||
| Hændelse | ||
| Forældre taxon | Bilaterale dyr (opsine) | |
Rhodopsin (også kaldet visuel lilla på grund af sin farve, især i ældre lærebøger og forskningsartikler ) er et lysfølsomt receptormolekyle . Rhodopsin er et af de visuelle pigmenter i nethinden (nethinden) i øjnene på hvirveldyr (hvirveldyr), i sammensatte øjne på insekter og i fotoreceptorerne hos andre hvirvelløse dyr (hvirvelløse dyr). Desuden forekommer rhodopsiner (se bacteriorhodopsin og channelrhodopsin ) også i bakterier , arkebakterier og encellede alger.
Hos mennesker og i de fleste hvirveldyrs øjne er rhodopsin i nethindens stænger ansvarlig for lys-mørkt syn ved lave lysstyrker ( scotopic vision ). I modsætning hertil er farvesyn eller dagsvisning ved hjælp af koglerne baseret på tre, og i en række dyrearter også fire forskellige varianter af iodopsin , et beslægtet visuelt pigment.
detaljer
Rhodopsin struktur
Rhodopsin består af en proteinbestanddel, stangen opsin ( scotopsin ), en transmembrant protein , og den kovalent bundne kromofor 11- cis - retinal . 11- cis retinal (aldehyd af retinol ) er bundet som en imin (Schiff's base) til ε-aminogruppen af en lysin i det 7. transmembrane domæne , som er lysin 296 i bovint rhodopsin. I nethindens stavceller lagres rhodopsin imidlertid ikke i cellemembranen, men er placeret i membranerne på skiveformede organeller (skiver) inde i cellen.
Vertebrate rhodopsins er medlemmer af den store familie af G-proteinkoblede receptorer (GPCR'er). Bovint rhodopsin var den første G-protein-koblede receptor, for hvilken en krystalstruktur opnået ved røntgenstrukturanalyse var tilgængelig (de syv spiralformede transmembrandomæner er blandt andet karakteristiske- se figur). Det fungerede derfor som en skabelon for modeller af andre GPCR'er, selvom aftalen i den primære struktur undertiden er meget dårlig. Krystalstrukturerne i mange andre GPCR'er er nu tilgængelige.
Processer i aktivering af rhodopsin med lys
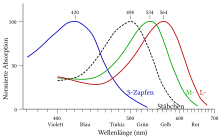
Den absorptionsmaksimum af rhodopsin i det synlige lys bølgelængdeområde er λ = 500 nm. Absorption af en enkelt foton i de passende energi range fører til isomerisering efter all-trans -retinal i 11- cis -retinal. Dette ændrer den rumlige struktur af nethinden, og interne interaktioner i molekylet fører til en række konformationelle ændringer i pigmentets proteindel, som omdanner rhodopsin til en metastabil aktiv tilstand kaldet Meta II. I forskning taler man om "blegning" ("blegning"), da pigmentet mister sin rødlige farve i løbet af aktiveringen. De ændrede funktionelle egenskaber ved aktiveret rhodopsin er grundlaget for en række hurtigt forekommende ændringer i cellen.
Lys- aktiveret rhodopsin i stangen celler i nethinden aktiverer G-proteinet transducin . Dette udløser den visuelle signaltransduktion , en flertrins reaktionskaskade, i løbet af hvilken den originale excitation moduleres og forstærkes mange gange. Dens slutpunkt er et elektrisk signal, der endelig transmitteres til hjernens visuelle centrum via nerveceller .
Mikrobielle rhodopsiner er derimod ofte lysaktiverede protonpumper , ionpumper eller ionkanaler placeret i cellemembranen : deres aktivering resulterer direkte i et elektrisk signal uden mellemliggende trin.
Processer for deaktivering og regenerering af rhodopsin
Den metastabile Meta II -tilstand vender også spontant tilbage til en inaktiv tilstand. Normalt - og især i forbindelse med visuelle transduktion i stangen celler i nethinden - aktiverede rhodopsin er deaktiveret ved en hurtigere enzymatisk proces - phosphorylering af enzymet rhodopsin kinase og binding af proteinet arrestin . I løbet af deaktivering er alle trans - retinal frigivet. For at regenerere det lysfølsomme rhodopsin skal 11- cis- retinal bindes igen. Dette involverer også komplekse, enzymatisk kontrollerede processer: All -trans -retinal til 11 -cis -retinal “genanvendes” uden for cellen i det tilstødende retinale pigmentepitel .
Medicinsk reference
Mutationer i opsin -genet kan føre til retinopathia pigmentosa og arvelig natblindhed .
Mangel på A -vitamin som en kilde til nethinden fører til natblindhed , tørhed i øjet ( xerophthalmia ) og hornhindebetændelse ( keratitis ) i øjet. A -vitaminmangel kan føre til blindhed hos børn. Dette er især almindeligt i udviklingslande på grund af den risbaserede kost . Det daglige behov for en voksen for vitamin A er fastsat til 800 µg i henhold til europæisk direktiv 90/496 / EØF (EU -ernæringsdirektiv).
relaterede emner
Et lignende molekyle, bacteriorhodopsin , findes i halobakterier . Den indeholder også nethinden og består også af syv transmembrane domæner . Det er imidlertid ikke knyttet til et G -protein. Det er en lysdrevet protonpumpe .
I højere grønne planter fungerer fytokrom derimod som en lysreceptor, der ligesom rhodopsin kan forekomme i forskellige tilstande og dermed giver planten information om de nuværende lysforhold.
Se også
Weblinks
Individuelle beviser
- ↑ Søgeresultat UniProt Opsins efter taksonomi .
- ↑ a b c Werner A. Müller, Stephan Frings, Frank Möhrlen: Dyre- og menneskelig fysiologi: En introduktion . Springer Spectrum, Berlin 2019, ISBN 978-3-662-58461-3 , Der Sehsinn, s. 605 ( [1] ).
- ↑ Christina Beck: Protozoer kaster lys over neurobiologi. www.mpg.de, 20. november 2014, tilgået den 2. oktober 2019 .
- ^ A b H. Gobind Khorana: Rhodopsin, fotoreceptor for stangcellen . I: Journal of Biological Chemistry . 267, nr. 1, 1992, s. 1-4.
- ↑ SB: Ghakasan et al:. G-proteinkoblede receptorer: udviklingen af strukturelle indsigt . I: AIMS Biophysics . 4, nr. 3, 2017, s. 491-527. PMC 6018013 (gratis fuld tekst).
- ^ Bowmaker & Mollon: Menneskestænger og kegler . 1983, værditabel ved 500 nm ( Color and Vision Research Labs )
- ↑ D. Baylor: Sådan starter fotoner synet . I: Proceedings of the National Academy of Sciences USA . 93, nr. 2, 1996, s. 560. PMC 40091 (fri fuld tekst).
- ^ PD Kieser et al.: Retinoid (visuel) cyklus kemi . I: Kemiske anmeldelser . 114, nr. 1, 2014, s. 194-232. PMC 3858459 (gratis fuld tekst).
- ↑ Kommissionens direktiv 2008/285 / EF (PDF) fra Kommissionen af 28. oktober 2008 om ændring af Rådets direktiv 90/496 / EØF om ernæringsmærkning af fødevarer med hensyn til de anbefalede daglige mængder, omregningsfaktorer for energiværdien og definitionerne .
