Idiopatisk interstitiel lungebetændelse
| Klassificering i henhold til ICD-10 | |
|---|---|
| J84.1 | Andre interstitielle lungesygdomme |
| ICD-10 online (WHO version 2019) | |
Den idiopatiske interstitielle lungebetændelse (IIP) danner en gruppe af sjældne sygdomsformer forårsaget af varierende grader af lungeinflammation ( lungebetændelse ) og ardannelse ( lungefibrose ), hovedsageligt bindevæv i lungerne ( interstitium ) er angivet. De adskiller sig med hensyn til sygdomstegn ( symptomer ), resultaterne hovedsageligt fra billeddannelsestest , patologien , sygdomsforløbet og behandlingsmulighederne. Årsagen til udviklingen af disse kliniske billeder vides ikke - de kaldes derfor " idiopatisk ". IIP tilhører den store gruppe af interstitiel lungesygdom (engelsk: I nterstitial L ung D isease eller ILD), hvor mere end 200 separate medicinske tilstande klassificeres . Det vigtigste symptom på interstitielle lungesygdomme er åndenød (dyspnø). Alle former for IIP fører til lungebetændelse af varierende sværhedsgrad, som primært påvirker bindevævet (interstitium) i lungerne . Det kan også forårsage ardannelse i lungerne kaldet lungefibrose. I nogle former er lungefibrose i forgrunden, og betændelse er kun en ledsagende reaktion. Den prognose eller forløbet af sygdommen og de behandlingsmuligheder afhænger blandt andet af, hvor vigtigt det er betændelse eller fibrose i den respektive form af sygdommen.
klassifikation
Den (ikke længere aktuelle) klassifikation af idiopatisk interstitiel lungebetændelse (IIP) vist her er baseret på en retningslinje offentliggjort af American Thoracic Society (ATS) og European Respiratory Society (ERS) i 2002. Ifølge denne klassificering skelnes der mellem syv sygdomsformer, som hver er defineret ved forskellige kliniske, radiologiske og patologiske kriterier. Derudover blev der indført en kategori for ikke-klassificerbare IIP'er, som alle sager er tildelt, som ikke kan afgrænses klart:
- idiopatisk lungefibrose (IPF, idiopatisk lungefibrose) ,
- ikke-specifik interstitiel lungebetændelse (NSIP) ,
- kryptogen organiserende lungebetændelse (COP) ,
- akut interstitiel lungebetændelse (AIP) ,
- respiratorisk bronchiolitis med interstitiel lungesygdom (RB-ILD) ,
- desquamative interstitiel lungebetændelse (DIP) og
- lymfoid interstitiel lungebetændelse (LIP) .
Klassifikationens betydning ligger først og fremmest i den tværfaglige definition af de forskellige former, som patologer , radiologer og internister stort set har gjort uafhængigt af hinanden i tidligere publikationer . Det blev gjort klart, at det histopatologiske mønster skal skelnes fra den kliniske diagnose. En pålidelig klinisk diagnose er baseret på kliniske, radiologiske og histopatologiske fund. Selvom bevisniveauet for klassificeringen er lavt, da det er baseret på resultaterne fra eksperter, danner det grundlaget for fremtidige undersøgelser, da der nu er ensartede kriterier på dette område.
Den nuværende klassifikation er den, der blev offentliggjort i fællesskab af American Thoracic Society (ATS) og European Respiratory Society (ERS) i 2013.
Epidemiologi
De epidemiologiske data om idiopatisk interstitiel lungebetændelse er ikke særlig pålidelige. Amerikansk arbejde med den overordnede gruppe af alle interstitielle lungesygdomme (ILD) blev udført blandt andet i New Mexico. Ifølge denne undersøgelse er forekomsten af ILD 80 tilfælde pr. 100.000 indbyggere hos mænd og 67 tilfælde pr. 100.000 indbyggere hos kvinder. En diagnose af lungefibrose og idiopatisk lungefibrose (IPF) udgør ca. 45 procent af alle tilfælde af ILD.
Ifølge denne undersøgelse er forekomsten af IPF 20 tilfælde pr. 100.000 indbyggere hos mænd og 13 tilfælde pr. 100.000 indbyggere hos kvinder. Da denne undersøgelse blev udført inden den nye klassificering blev offentliggjort, er gyldigheden af disse oplysninger tvivlsom. En nyere undersøgelse antager en højere prævalens. Der er beviser for, at IPF stiger i vestlige lande. Epidemiologien af de andre former for IIP er endnu mindre velundersøgt.
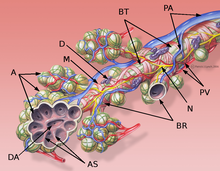
Anatomiske basics

PB : peribronkial bindevæv, BT : terminal bronchiolus, M : cirkulær muskel lag af bronchiolus, P : gren af lungepulsåren, DA : alveolær kanal, A : alveoler, AS : alveolær septa.
Farvning med hæmatoxylin-eosin (HE).
Interstitium (interstitielt væv) i lungen er i form af såkaldt interalveolarepten mellem væggene i luftsækkene (alveoler). Sidstnævnte repræsenterer det faktiske funktionelle lungevæv ( parenkym ), fordi gasudvekslingen mellem blod og luft finder sted i dem . Interstitium og parenkym arbejder tæt sammen i lungemekanik og danner en funktionel enhed. Interstitium er den grundlæggende struktur i lungerne og opretholder arkitekturen af alveolerne og dermed blod-luftbarrieren under åndedrætscyklussen. Bindevævsdelen af den interalveolære septa består af celler, især bindevævsbyggere ( fibroblaster ), de strukturelle proteiner, de danner, og stoffer såsom kollagen , elastiske fibre , proteoglycaner og andre glycoproteiner .
Hoveddelen af interstitiet består af kollagenfibre, der udgør op til 20 procent af den tørre lungemasse. I lungens mellemrum dominerer kollagen type I, hvilket menes at spille hovedrollen i opretholdelse af alveolernes form og elasticitet. Type IV er kun til stede i kældermembranerne i alveolerne og blodkarrene. Type III og V kollagen dannes kun i en lille grad (5 til 10 procent) i lungevævet. De elastiske fibre danner et forgrenet netværk i lungerne. De er drivkraften for udånding ( udløb ).
Proteoglycaner danner det grundlæggende stof i interstitiumet, de sikrer, at den rumlige struktur i lungevævet opretholdes. Deres nøjagtige rolle i lungefunktionen er ikke kendt i detaljer. Hyaluronsyre , chondroitinsulfat A og C , dermatansulfat , heparin og heparinsulfat findes i lungerne . Andre glycoproteiner inkluderer fibronectin og laminin , som hovedsageligt findes i kældermembranerne.
Patogenese
De mekanismer, der bidrager til udviklingen af en sygdom, kaldes patogenese . I idiopatisk interstitiel lungebetændelse (IIP) spiller inflammation og fibrose i lungevævet en afgørende rolle. De har en anden status i de forskellige former. Patogenesen forstås imidlertid ikke fuldt ud.
betændelse
I de fleste interstitielle lungesygdomme og de fleste former for idiopatisk interstitielle lungebetændelser ser det ud til, at det inflammatoriske respons spiller den afgørende rolle i patogenesen. En mikroskopisk undersøgelse afslører store ophobninger af inflammatoriske celler ( makrofager , granulocytter og lymfocytter ) i lungevævet af disse sygdomme, især i de tidlige stadier . Fibroseområder forekommer kun i ringe grad og udvikler kun sjældent lungefibrose i slutstadiet. Den lungefibrose er derefter en konsekvens af den inflammatoriske reaktion. Denne teori forstærkes af det faktum, at sygdommene reagerer godt på antiinflammatoriske og immunsuppressive behandlinger. Fjernelse af betændelsen, der forårsager lungefibrose, kan forhindre yderligere progression.
Idiopatisk lungefibrose og sandsynligvis også akut interstitiel lungebetændelse indtager en særlig position. Hypotesen om, at en inflammatorisk reaktion er betingelsen for udvikling af lungefibrose, synes ikke at opretholdes her. Den inflammatoriske reaktion spiller naturligvis en underordnet rolle her eller er kun en ledsagende reaktion på lungefibrose.
Lungefibrose
Den lungefibrose er en reaktion, hvor det kommer til ardannelse i lungevævet. Forskellige celletyper spiller en vigtig rolle i udviklingen af lungefibrose. Så vidt vi ved i dag, er de vigtigste fibroblaster, endotelceller og alveolære epitelceller . Efter beskadigelse af lungevævet, hvis årsag er ukendt i idiopatisk interstitiel lungebetændelse, bliver fibroblasterne enten først betændte og aktiveres derefter, eller de aktiveres direkte, dvs. uden forudgående betændelse. Dette afhænger af, hvilken model der bruges. Aktivering af fibroblasterne initieres af forskellige messenger-stoffer, for eksempel vækstfaktorer, såsom transformation af vækstfaktor beta 1 (TGF-β1) og forskellige interleukiner , der frigøres fra andre celler og fibroblasterne selv. Dette fører til cellemultiplikation ( proliferation ) af fibroblasterne såvel som til en ny dannelse af basisk stof og bindevævsfibre. Normalt er denne reaktion strengt reguleret, hvilket betyder, at efter at skaden eller såret er helet, hæmmes fibroblasternes aktivitet: på den ene side ved lavere frigivelse af messenger-stoffer på den anden side ved programmeret celledød ( apoptose ) af fibroblasterne. Disse reguleringsmekanismer fungerer ikke tilstrækkeligt i lungefibrose. Dette fører til, at der dannes for meget bindevæv. Den alveolære septa bliver bredere og forårsager en gasudveksling eller diffusionsforstyrrelse ( respirationsinsufficiens ). Derudover mister lungerne deres fleksibilitet ( overholdelse ) og kan kun udvide sig tilstrækkeligt under indånding gennem øget vejrtrækningsarbejde. En såkaldt restriktiv ventilationsforstyrrelse udvikler sig . Begge faktorer - gasudvekslingsforstyrrelsen og den restriktive ventilationsforstyrrelse - fører til det vigtigste symptom på lungefibrose, dyspnø. I avancerede stadier af lungefibrose migrerer fibroblasterne også ind i lumen i alveolerne, hvor de også danner nyt bindevæv. Fibrotiske områder dannes i alveolerne, som er kendt som fibrotiske foci . Dette ødelægger lungestrukturen i disse områder, hvilket ledsages af et fuldstændigt tab af funktion.
Symptomer
Hovedsymptomet på idiopatisk interstitiel lungebetændelse er, som de fleste andre interstitielle lungesygdomme, åndenød, som i den indledende fase kun forekommer ved fysisk anstrengelse. Da IIP typisk er en restriktiv ventilationsforstyrrelse, har de berørte primært problemer med at trække vejret ind. Med avanceret sværhedsgrad ( progression ) af sygdommen kan dyspnøen, afhængigt af sygdommens form, også forekomme i hvile, og i slutstadiet kan sygdommene blive til respirationsinsufficiens. Lungfibrose er også kendetegnet ved en tør hoste uden ekspektoration .
På grund af lungernes begrænsede funktionalitet med hensyn til gasudveksling og overholdelse kan der forekomme iltmangel i blodet, kendt som hypoxæmi . Dette kan manifestere sig i form af cyanose , dvs. en lilla til blålig misfarvning af hud, slimhinder og fingernegle. Også clubbing og Watchglass kan dannes som et tegn på hypoxæmi. I tilfælde af alvorlig iltmangel kan nedsat bevidsthed også forekomme.
diagnose
Grundlæggende diagnostik
Sygehistorie og fysisk undersøgelse
I begyndelsen af undersøgelsen er der en detaljeret medicinsk historie ( anamnese ). Blandt andet bliver patienterne spurgt om deres aktuelle klager, kendte sygdomme, medicin, de har taget, og sygdomme hos deres pårørende. Anamnese er meget vigtig, da den hjælper med at udelukke andre sygdomme og stille en mistanke om diagnose. I mange sygdomme beskriver patienten karakteristiske symptomer, så den mistænkte diagnose ofte viser sig at være den rigtige efter yderligere undersøgelser.
Frankfurter Bogen , som er udbredt i tysktalende lande, kan være nyttig til lungesygdomme . Denne formular udfyldes af patienten og tager næsten alle vigtige aspekter, der er vigtige i tilfælde af lungesygdomme, i betragtning. Symptomerne på idiopatisk interstitiel lungebetændelse er ikke-specifikke. Åndenød, der forekommer i alle former for IIP, indikerer, at der kan være en lungesygdom, men det kan også være forårsaget af adskillige andre sygdomme, såsom hjertesygdomme. Dette gælder også på samme måde som de andre beskrevne symptomer. Diagnosen eller den mistænkte diagnose af IIP kan derfor ikke stilles udelukkende på basis af anamnese.
Sygehistorien efterfølges normalt af en detaljeret fysisk undersøgelse . I tilfælde af lungesygdomme er fokus på at se ( inspicere ) hele kropsoverfladen, banke ( percussion ) på brystet og lytte ( auskultation ) af lungerne med et stetoskop . Det er primært de ændringer, der er typiske for fibrose, der kan afsløres under en IIP med en fysisk undersøgelse. Ofte kan man høre en klar knitrende rasling i auskultation , som også er kendt som sklerofoni og er kendetegnet ved baggrundsstøj med fine bobler, der opstår mod slutningen af indånding og udånding. Ved hjælp af percussion kan de hævede lungegrænser, som også er typiske for lungefibrose, afsløres. Symptomerne cyanose, trommestikfingre og ur nævnte glasnegle bemærkes under inspektionen. Den fysiske undersøgelse tillader heller ikke en pålidelig diagnose i IIP, men det kan yderligere begrænse området for mulige sygdomme.
Tekniske undersøgelsesprocedurer
Grundlæggende diagnostik til formodet ILD eller IIP inkluderer tekniske undersøgelsesprocedurer, især undersøgelse af lungefunktion og røntgen af brystet. Kropspletysmografi spiller en vigtig rolle i vurderingen af lungefunktionen . Lungfibrose resulterer i en restriktiv ventilationsforstyrrelse, som kan påvises ved hjælp af denne metode. I de tidlige stadier af sygdommen er der muligvis ingen tegn på en sådan lidelse. En blodgasanalyse før og efter fysisk anstrengelse samt bestemmelse af CO-overførselsfaktoren kan give indikationer på tilstedeværelsen af en IIP selv i de tidlige stadier. Begge undersøgelsesmetoder hører også til repertoiret for grundlæggende diagnostik.
Fibrotiske ændringer kan også synliggøres på røntgenstråler i lungerne. Også her kan ændringer i de tidlige stadier være så små, at de ikke kan bruges med konventionel røntgendiagnostik. Typiske tegn på lungefibrose på røntgenbilleder er konsolideringer , trækkraft bronkiektasi og matteret glas skygger. Konsolideringer er forårsaget af fibrotisk væv i alveolerne og fremstår som lyse områder i røntgenbilledet, da de er elektrontætte end luftfyldte alveoler. Trækkraft bronchiectasis er en udvidelse af bronchi og er forårsaget af spændingen, der er placeret på dem, som i lungefibrose er forårsaget af krympning af lungevævet. De frostede glasskygger er også lyse områder, der er forårsaget af ødelæggelsen af lungearkitekturen.
Yderligere diagnostik
Hvis der efter den grundlæggende diagnose er en presserende mistanke om IIP, udføres der normalt en speciel computertomografi (CT), kendt som højopløsnings-CT . Sammenlignet med normal CT opnår dette en højere opløsning. Med HRCT kan de fleste tilfælde af IIP identificeres med en høj grad af sandsynlighed, og de forskellige former for sygdommen kan differentieres. Typiske egenskaber ved lungefibrose i CT ud over mælkeglasskygge og Traktionsbronchiektasien en såkaldt bikagelunge eller kort bikagekage (engl. Honeycombing ). Honningkagelungen kaldes på grund af dens lignende struktur til bikagekagen . Honningkagerne opstår som et resultat af degeneration af lungevævet.
Hvis en diagnose eller differentiering ikke er mulig med denne metode, skal invasive undersøgelsesprocedurer anvendes. Det første trin i invasive undersøgelser er bronkoskopi med bronchoalveolær skylning (BAL) og transbronchial biopsi . Hvis dette heller ikke udelukker eller bekræfter diagnosen, skal der udføres en thoracotomi (åben lungebiopsi) eller videoassisteret thoracoscopy ( VATS ), hvilket er guldstandarden i diagnosen IIP. I henhold til anbefalingerne fra konsensuskonferencen skal der udtages mindst tre prøver fra forskellige lungelapper, hver med en minimumsstørrelse på 2 cm.
terapi
Farmakologisk terapi
Terapi af idiopatisk interstitiel lungebetændelse (IIP) udføres i det væsentlige med to grupper af lægemidler. På den ene side med et glukokortikoid , såsom prednisolon , og på den anden side med såkaldte immunsuppressiva , især azathioprin og cyclophosphamid . Effektiviteten af medicinen afhænger af, hvilken type IIP patienten lider af. Mens farmakologisk terapi i idiopatisk lungefibrose (IPF) og akut interstitiel lungebetændelse (AIP) ikke har nogen eller kun en midlertidig virkning på sygdomsforløbet, reagerer de andre former godt på antiinflammatorisk behandling, så der sker heling eller i det mindste den gennemsnitlige overlevelsestid kan forlænges betydeligt.
De forskellige reaktioner på antiinflammatorisk terapi skyldes sandsynligvis en anden patogenese af de forskellige former. Ifølge den nuværende forskningstilstand er fibrose i forgrunden i IPF og AIP, og den inflammatoriske reaktion er kun en ledsagende reaktion eller en konsekvens af den. I de andre former er det derimod betændelsen i det pulmonale interstitium, der bestemmer sygdomsforløbet, og som kun overlejres af fibrose i sygdommens slutfase.
Til behandlingen af IPF og AIP lægges der derfor store forhåbninger til stoffer, der kan hæmme udviklingen af fibrose, dvs. celleproliferationen af fibroblasterne og kollagensyntese. Et stort antal af sådanne stoffer er i øjeblikket (2008) i kliniske studier . De er dog endnu ikke godkendt til standard IIP-behandling.
Lungetransplantation
En lungetransplantation kan overvejes, hvis IIP eller lungefibrose er i de sidste stadier og ikke reagerer på lægemiddelbehandling. Lungetransplantation øger overlevelsesraten i fremskreden lungefibrose. Transplantation af en lunge svarer til transplantation af to lunger. Indikationen for en lungetransplantation foretages ofte ikke i tide. Ifølge en undersøgelse, der omfattede 1.376 patienter, døde mere end 30 procent af at vente længe før lungetransplantationen kunne udføres.
Kliniske forskelle i idiopatisk interstitiel lungebetændelse
Idiopatisk lungefibrose (IPF)
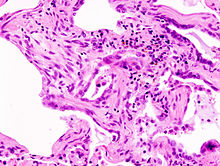
Den idiopatiske lungefibrose eller idiopatisk lungefibrose er den mest almindelige IIP og har den værste prognose. Den gennemsnitlige overlevelsestid efter diagnose er i gennemsnit tre år, og den femårige overlevelsesrate er mellem 20 og 40 procent. Patienterne er normalt ældre end 60 år på diagnosetidspunktet, og mænd rammes noget oftere end kvinder. Den Forekomsten er omkring 6 / 100.000.
De morfologiske ændringer er hovedsageligt lokaliseret i området af lungebasen, dvs. i det nedre område af lungerne. Det typiske histologiske mønster af IPF kaldes U sual I nterstitial P neumonia betegnet (UIP, sædvanlig interstitiel lungebetændelse) og er karakteriseret ved en ujævn fibrose såvel som en bikagelignende struktur i lungen. UIP-mønsteret er karakteristisk, men ikke specifikt, for IPF og findes også i andre interstitielle lungesygdomme. I de avancerede stadier af sygdommen viser røntgen en basal retikulær (retikulær) vaskulær struktur. I HRCT (høj opløsning computertomografi) er trækkraft bronchiectasis og bikager med en basal og subpleural fordeling typisk.
Udbruddet af IPF-sygdommen er snigende og karakteriseret ved stigende åndenød, tør, irritabel hoste og knitrende ved den pulmonale auskultation. IPF kan også forekomme i løbet af eksisterende lungesygdomme, for eksempel kombineret med emfysem ved KOL ; Rygning er også en risikofaktor for IPF. IPF reagerer generelt ikke på behandling med glukokortikoider, selv ikke i kombination med immunsuppressive lægemidler. Lungetransplantation ses som en effektiv terapeutisk foranstaltning i særlige tilfælde. Pirfenidon (handelsnavn Esbriet® ) er blevet godkendt som et lægemiddel i EU siden 2011 og i USA siden 2014 i tilfælde, der endnu ikke er meget avancerede. Ifølge de oprindelige data nedsætter denne aktive ingrediens sygdomsforløbet; Almindelige bivirkninger er svimmelhed, kvalme, udslæt, øget hudfølsomhed over for lys. I 2015 blev nintedanib (handelsnavn Ofev® ) godkendt til alle sygdomsstadier af IPF i USA og Europa.
Ikke-specifik interstitiel lungebetændelse (NSIP)
Den ikke-specifikke interstitiel lungebetændelse (NSIP) er under den idiopatiske interstitielle lungebetændelse (IIP), den næst mest almindelige og mest varianter form. De berørte er for det meste mellem 50 og 60 år gamle og dermed i gennemsnit noget yngre end patienter med IPF. Kvinder og mænd er lige berørt.
NSIP viser ingen typisk lokalisering med hensyn til de morfologiske ændringer. Snarere er ændringerne homogene og for det meste symmetrisk fordelt over hele lungerne. Det histologiske mønster kaldes også NSIP. Der er to undergrupper (undertyper) af NSIP, en cellulær og en fibrotisk undertype. I den cellulære undertype er det histologiske udseende domineret af inflammatoriske celler; i den fibrotiske undertype er der også udtalt fibroseområder. Ligesom det histologiske billede er det radiologiske billede også rig på variationer. Ud over diffust distribuerede mælkeglasopaciteter er der mikronoduler og bikager. I avancerede stadier er den normale lungestruktur vanskelig at se på røntgen- og CT-billeder, fordi den er blevet ødelagt af bronchiectasis, cyster og konsolideringer.
Symptomerne på NSIP adskiller sig kun lidt fra IPF's. Det viser dog et mildere forløb, skrider langsommere og har en bedre prognose. Prognosen afhænger også af den histologiske undertype og er bedre for den cellulære undertype end for den fibrotiske undertype, da dette er mere lydhør over for antiinflammatorisk behandling. Samlet set er lægemiddelterapi meget mere lovende end tilfældet er med IPF. Da de morfologiske ændringer i NSIP er så varierede, er diagnosen den sværeste for læger sammenlignet med andre IIP'er. Dette gælder især for den fibrotiske undertype.
Kryptogen organiserende lungebetændelse (COP)
Da kryptogen organiserende lungebetændelse ( kryptogen organiserende lungebetændelse ) refereres til et klinisk billede, er de kliniske, radiologiske og patologiske træk ret karakteristiske. Som med NSIP er der ingen kønspræference i COP, og gennemsnitsalderen for patienter er mellem 50 og 60 år. Ikke-rygere rammes omtrent dobbelt så ofte som cigaretrygere. Årsagen til denne statistiske abnormitet er ukendt.
Det histologiske mønster kaldes organisering af lungebetændelse (OP). Det er kendetegnet ved udseendet af granuleringsvæv, der fylder bronchiolerne og alveolerne. Disse ændringer ødelægger ikke parenkymet i lungerne. Dette mønster forekommer sjældent i idiopatisk form. Ofte kan andre sygdomme holdes ansvarlige for disse ændringer som en sekundær årsag, for eksempel kollagenoser og infektiøse eller lægemiddelinducerede sygdomme. En lignende histologi forekommer i bronchiolitis obliterans . Af denne grund var COP tidligere kendt som bronchiolitis obliterans organizing pneumonia (BOOP) . For at undgå forveksling med det uafhængige kliniske billede af bronchiolitis obliterans er dette udtryk ikke længere i brug. Granuleringsvævet vises på røntgen- og CT-billeder i form af såkaldte konsolideringsområder , som hovedsageligt er placeret i området omkring bronchi (peribronchial) og direkte under pleura (subpleural). Frostet glasskygge kan forekomme omkring konsolideringerne.
Det kliniske billede begynder normalt med generelle symptomer som utilpashed, feber , vægttab og tør hoste. Symptomerne stiger inden for en til tre måneder. COP kan behandles godt med glukokortikoider og har en god prognose. Ofte blusser sygdommen op igen efter seponering af behandlingen. Dette er kendt som tilbagefald . Hvis der opstår tilbagefald, kan sygdommen behandles igen med glukokortikoider.
Akut interstitiel lungebetændelse (AIP)
I modsætning til anden idiopatisk interstitiel lungebetændelse (IIP) har akut interstitiel lungebetændelse (AIP) et akut forløb. Det er kendetegnet ved pludselig debut af symptomer og fører ofte til en progressiv åndedrætsforstyrrelse ( åndedrætsinsufficiens ). Sygdommen har den værste prognose for IIP. Kurset er fatalt i over halvdelen af tilfældene. De fleste dødsfald forekommer en til to måneder efter sygdommens begyndelse.
Begyndelsen af AIP er ofte forud for en infektion i de øvre luftveje , som kan karakteriseres ved en generel sygdomsfølelse, smerter i lemmerne , feber og kulderystelser. Patienten udvikler derefter åndenød (dyspnø) inden for få dage, hvilket oprindeligt kun forekommer under træning. Mangel på ilt i blodet (hypoxæmi) kan allerede påvises i de tidlige stadier. Et andet kendetegn er en klar knitrende rasling, som skal vurderes som et tegn på konsolidering i forbindelse med en restriktiv ventilationsforstyrrelse. Mangel på ilt i blodet ( hypoxæmi ) udvikler sig til åndenød i hvile (hvilende dyspnø) inden for få uger, hvilket kan blive til respirationsinsufficiens. På dette tidspunkt skal patienten tilføres ilt og under visse omstændigheder mekanisk ventileres.
Det histologiske mønster er som diffus alveolær skade (Engl. Diffus alveolær skade , kort- DAD ) kaldet og kan ikke skelnes fra patologiske ændringer i akut respiratorisk nødsyndrom hos voksne (Engl. Akut respiratorisk nødsyndrom , kort ARDS ) kan forekomme. AIP og ARDS er kun forskellige i årsagen. Mens ARDS primært forekommer i sammenhæng med sepsis eller chok , er årsagen til AIP ukendt. Louis Virgil Hamman og Arnold Rice Rich beskrev lignende tilfælde allerede i 1940'erne, som senere blev opsummeret som Hamman-Rich syndrom . Sandsynligvis er disse tilfælde beskrivelsen af det, der nu kaldes AIP.
Luftvejsbronkiolitis med interstitiel lungesygdom (RB-ILD) og deskvamativ interstitiel lungebetændelse (DIP)
Når respiratorisk bronchiolitis interstitiel lungesygdom og desquamative interstitiel lungebetændelse er sygdom med et lignende men adskilleligt udseende. Begge sygdomme forekommer hovedsageligt, udelukkende RB-ILD og DIP som regel hos rygere. Den gennemsnitlige alder for debut er omkring 40-50 år, og mænd påvirkes dobbelt så ofte som kvinder. RB-ILD er den symptomatiske variant af respiratorisk bronchiolitis, en betændelse i bronchiolerne, som regelmæssigt tilfældigt kan findes hos rygere. Det histologiske mønster for den asymptomatiske og den symptomatiske variant kaldes også respiratorisk bronchiolitis (RB).
DIP betragtes af nogle eksperter som den avancerede variant af RB-ILD. Dette er dog tvivlsomt, da DIP i modsætning til RB-ILD lejlighedsvis også forekommer hos ikke-rygere og på grund af de betydelige morfologiske forskelle (se nedenfor). På grund af denne usikkerhed giver konsensusklassifikationen mulighed for en adskillelse af de to varianter. Udtrykket DIP blev introduceret i 1969 af Liebow og Carrington under den falske antagelse, at disse celleklynger var eksfoliering fra alveolær epitel. Denne afskalning af celler kaldes desquamation (fra den latinske squama "skalaer"). Ikke desto mindre er udtrykket DIP bevaret i den nuværende klassifikation, dels fordi DIP er en sjældenhed og ikke er blevet erstattet af det mere passende udtryk alveolær makrofag lungebetændelse . DIP's histologiske mønster kaldes også DIP.
Det histologiske billede af begge former er kendetegnet ved talrige ophobninger af brunpigmenterede makrofager i lungerne. I RB-ILD er de pigmenterede makrofager overvejende placeret i bronchioles lumina (bronchiolocentrically), mens de i DIP overvejende findes i lumina af alveolerne (intraalveolar). Mild fibrose er også karakteristisk for DIP. De to kliniske billeder adskiller sig også i fordelingen af de morfologiske ændringer. Mens RB-ILD hovedsageligt findes i de øvre lunger i lungerne, har DIP en foretrukken subpleural lokalisering med dominans i de nedre lapper. Dette fordelingsmønster er særlig let at detektere i HRCT. Såkaldte centrilobulære knuder er karakteristiske for RB-ILD, og frostede glasskygger er karakteristiske for DIP.
De kliniske symptomer er kendetegnet ved en langsom udvikling af åndenød og tør, kold hoste. Trommestikfingre findes også hos omkring halvdelen af patienterne. Begge former reagerer godt på glukokortikoider og har en god prognose. Kun i sjældne tilfælde udvikler DIP respirationsinsufficiens, som har en høj dødelighed.
Lymfoid interstitiel lungebetændelse (LIP)
LIP forekommer fortrinsvis hos kvinder med en alderstop omkring 50 år. I idiopatisk form er LIP den sjældneste IIP. Det forekommer meget oftere som en sekundær forekomst i forbindelse med autoimmune sygdomme og immundefekt .
Den histologiske mønster, ligesom den kliniske diagnose, kaldes LIP og er kendetegnet ved infiltration af alveolære septa med lymfocytter og makrofager og den peribronkial dannelse af lymfeknuder follikler . Ændringerne er diffuse gennem lungerne. I HRCT er frostede glasskygger karakteristiske.
Patienterne har kun milde symptomer og lider hovedsageligt af let åndenød og hoste. I de sekundære former er symptomerne på den underliggende sygdom i forgrunden. I sjældne tilfælde kan LIP udvikle sig til lungefibrose eller ondartet lymfom . Bortset fra denne komplikation har LIP en god prognose. Terapien udføres normalt med glukokortikoider, hvis effektivitet i denne form for IIP endnu ikke er bevist ved randomiserede undersøgelser.
Idiopatisk interstitiel lungebetændelse hos dyr
Gruppen af idiopatisk interstitiel lungebetændelse hos dyr er indtil videre blevet lidt undersøgt. Derfor er der intet egnet modeldyr til basale studier - bleomycin- induceret lungefibrose hos gnavere er bare en sygdom, der ( fænomenologisk ) ligner udseende , men ikke opfylder kravene i en passende model.
Sådanne kroniske idiopatiske sygdomme kan findes oftere hos nogle terrierracer ( West Highland White Terriers , Staffordshire Bull Terriers , Scottish Terriers ). Den hund idiopatisk lungefibrose sker hovedsageligt i ældre dyr og svarer til den kryptogenisk organiserende lungebetændelse hos mennesker. Kun få tilfælde af IIP er blevet beskrevet i litteraturen hos katte; ifølge en nylig undersøgelse svarer det til idiopatisk lungefibrose (IPF) hos mennesker og er sandsynligvis forårsaget af en defekt i type II pneumocytter .
Indtil videre har der kun været en enkelt sag om en blåfrontet papegøje hos fugle .
Forskningshistorie
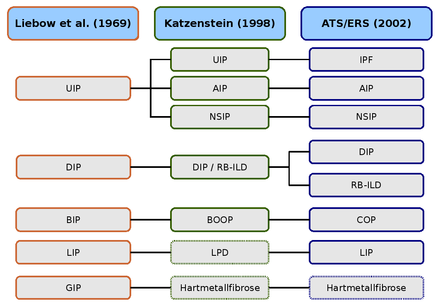
AIP (akut interstitiel lungebetændelse),
BIP (bronchiolitisk interstitiel lungebetændelse),
BOOP (bronchiolitis obliterans med organiserende lungebetændelse),
COP (kryptogen interstitiel lungebetændelse),
DIP (deskvamativ interstitiel lungebetændelse),
GIP (gigantisk cellepneumoni),
LPD (lymfoproliferativ sygdom)
LIP (lymfoid interstitiel lungebetændelse),
NSIP ( uspecifik interstitiel lungebetændelse),
RB-ILD (respiratorisk bronchiolitis med interstitiel lungesygdom),
UIP (sædvanlig interstitiel lungebetændelse).
Den første beskrivelse af en interstitiel lungesygdom går tilbage til året 1892 og kommer fra den canadiske læge William Osler . Han anerkendte allerede det forskelligartede udseende og påpegede nødvendigheden og vanskeligheden ved en yderligere klassificering af ændringerne.
Den internist Louis Virgil Hamman og patologen Arnold Rice Rich rapporterede i 1944 om fire patient tilfælde er ramt af akut diffus interstitiel fibrose. Den Hamman-Rich syndrom blev opkaldt efter dem. Dette udtryk blev derefter brugt i et stykke tid for alle sygdomme, hvor der var kronisk diffus fibrose i lungerne med en ukendt årsag, skønt de beskrevne tilfælde var akutte. Forfatterne beskrev sandsynligvis det, der nu kaldes akut interstitiel lungebetændelse.
Den første histologiske klassifikation af idiopatiske interstitielle lungesygdomme kommer fra de to patologer Averill Abraham Liebow og Charles B. Carrington (1969). Klassifikationen på det tidspunkt differentierede fem histologiske mønstre, som først blev inkluderet under paraplybetegnelsen idiopatisk lungefibrose . Hamman-Rich-syndromet var en akut variant af " U sual I nterstitial P- klassificeret neumoni" (UIP, almindelig interstitiel lungebetændelse).
Liebow-Carrington-klassificeringen blev videreudviklet i 1997 af Anna-Luise A.Katzenstein og i 1998 i samarbejde med Jeffrey L. Myers og tilpasset den nuværende tilstand af forskning. Årsagen til " G iant I nterstial P neumonia" (GCP, kæmpecelle lungebetændelse) er nu blevet belyst. Det udløses ved indånding af metalstøv og er kendt som hårdmetalfibrose . Lymfoid interstitiel lungebetændelse blev tildelt de "lymfoproliferative sygdomme" (LPD, lymfoproliferative sygdomme).
Individuelle beviser
- Bemærk : Medmindre andet er angivet, bygger artiklen på publikationen om konsensuskonference i 2002: American Thoracic Society / European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. I: Am J Respir Crit Care Med. 165 (2), 15. jan. 2002, s. 277-304. PMID 11790668 . doi : 10.1164 / ajrccm.165.2.ats01 .
- ↑ a b c d American Thoracic Society / European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. I: Am J Respir Crit Care Med. 165 (2), 15. jan. 2002, s. 277-304. PMID 11790668 . doi : 10.1164 / ajrccm.165.2.ats01 .
- ↑ GW Hunninghake, MI Black: state of the art. Forklarer nuværende viden patogenesen af idiopatisk lungefibrose?: Et perspektiv. I: Proc Am Thorac Soc. 4 (5), sep 2007, s. 449-452. PMID 17684287 . doi : 10.1513 / pats.200702-036MS .
- ^ KO Leslie: Historisk perspektiv: en patologisk tilgang til klassificering af idiopatiske interstitielle lungebetændelser. I: Bryst. 128 (5 Suppl 1), nov 2005, s. 513S-519S. PMID 16304241 . doi : 10.1378 / chest.128.5_suppl_1.513S .
- ↑ U. Costabel: Idiopatisk interstitiel lungebetændelse - hvorfor en anden konsensusklassifikation? I: Pneumologi. 56, 2002, s. 279-280. doi : 10.1055 / s-2002-30703 .
- ↑ Gerd Herold og kolleger: Intern medicin 2021. Selvudgivet, Köln 2021, ISBN 978-3-9821166-0-0 , s. 393.
- ^ DB Coultas et al.: Epidemiologien ved interstitielle lungesygdomme. I: Am. J. Respir. Crit. Care Med. Bind 150, nr. 4, 10, 1994, s. 967-972. doi : 10.1164 / ajrccm.150.4.7921471 .
- ↑ G. Raghu et al:. Forekomst og forekomsten af idiopatisk lungefibrose. I: Am J Respir Crit Care Med. 174 (7), 1. oktober 2006, s. 810-816. Epub 2006 29. juni. PMID 16809633 . doi : 10.1164 / rccm.200602-163OC .
- ^ Francis HY Green: Oversigt over lungefibrose. I: Bryst. 122, 2002, s. 334S-339S. doi : 10.1378 / chest.122.6_suppl.334S .
- ^ JE Gadek et al: Bindevævets proteasers rolle i patogenesen af kronisk inflammatorisk lungesygdom. I: Miljø Health Perspect . 55, apr 1984, s. 297-306. PMID 6329673 . doi : 10.1289 / ehp.8455297 .
- ^ TE King: Idiopatisk interstitiel lungebetændelse: fremskridt inden for klassificering, diagnose, patogenese og styring. I: Trans Am Clin Climatol Assoc. 115, 2004, s. 43-78. PMID 17060957 .
- ↑ Gross et al.: Idiopatisk lungefibrose. I: N Engl J Med . 345, 2001, s. 517-525. doi : 10.1056 / NEJMra003200 .
- ^ BC Willis et al .: Epitel oprindelse af myofibroblaster under fibrose i lungen. I: Proc Am Thorac Soc. 3 (4), juni 2006, s. 377-382. PMID 16738204 . doi : 10.1513 / pats.200601-004TK .
- ↑ R. Klinke, S. Silbernagl (red.): Textbook of Physiology. 4. udgave. Thieme-Verlag, 2003, ISBN 3-13-796004-5 .
- ↑ M. Dietel et al.: Harrisons interne medicin. 15. udgave. ABW Wissenschaftsverlag, Berlin 2003, ISBN 3-936072-10-8 .
- ↑ H. Kronenberger et al .: Et nyt spørgeskema til registrering af lunge- og luftvejssygdomme. I: Prax. Clin. Pneumol. 39, 1985, s. 241-251.
- ↑ a b c Günther et al .: Klassificering, diagnose og terapi af idiopatisk interstitiel lungebetændelse: En kritisk oversigt over den praksis, der i øjeblikket praktiseres i Tyskland. I: Deutsches Ärzteblatt. 24, 13. juni 2003 ( html-version ), (PDF-version) ( Memento fra 30. juli 2004 i internetarkivet ).
- ↑ en b Kauffmann et al .: Radiology. 3. udgave. Urban & Fischer München / Jena 2006, ISBN 3-437-44415-8 .
- ↑ U. Costabel et al .: Pulmonal fibroses - klassificering, diagnose, terapi. I: Internist. [Suppl 1] 44, 2003, s. S35-S43. doi : 10.1007 / s00108-003-0977-6 .
- ↑ JD Hosenpud et al.: Effekt af diagnose på overlevelsesfordel ved lungetransplantation til end-stadium lungesygdom. I: The Lancet . 351 (9095), 3. jan. 1998, s. 24-27. PMID 9433425 . doi : 10.1016 / S0140-6736 (97) 06405-2 .
- ↑ BF Meyers et al.: Single versus bilateral lungetransplantation for idiopatisk lungefibrose: en ti-årig institutionel oplevelse. I: J Thorac Cardiovasc Surg . 120, 2000, s. 99-107. PMID 10884661 . doi : 10.1067 / mtc.2000.106322 .
- ^ J. De Meester et al .: Venteliste til lungetransplantation: differentielt resultat af typen af slutstadiet lungesygdom, et år efter registrering. I: J Heart Lung Transplant . 18 (6), juni 1999, s. 563-571. PMID 10395354 . doi : 10.1016 / s1053-2498 (99) 00002-9 .
- ^ DS Kim et al: Klassificering og naturhistorie af de idiopatiske interstitielle lungebetændelser. I: Proc Am Thorac Soc. 3 (4), juni 2006, s. 285-292. PMID 16738191 . doi : 10.1513 / pats.200601-005TK .
- ↑ David A Lynch, Nicola Sverzellati, William D Travis, Kevin K Brown, Thomas V Colby: Diagnostiske kriterier for idiopatisk lungefibrose: en hvidbog fra Fleischner Society . I: The Lancet Respiratory Medicine . bånd 6 , nr. 2. februar 2018, s. 138-153 , doi : 10.1016 / S2213-2600 (17) 30433-2 .
- ↑ PW Noble et al.: Pirfenidon hos patienter med idiopatisk lungefibrose (CAPACITY): to randomiserede forsøg. I: Lancet. 377 (9779), 21. maj 2011, s. 1760-1769. doi: 10.1016 / S0140-6736 (11) 60405-4 . Epub 2011 13. maj.
- ^ H. Monaghan et al.: Prognostiske implikationer af histologiske mønstre i flere kirurgiske lungebiopsier fra patienter med idiopatisk interstitiel lungebetændelse. I: Bryst. 125 (2), feb 2004, s. 522-526. PMID 14769733 . doi : 10.1378 / bryst.125.2.522 .
- ↑ Se også Joachim Frey : Sygdomme i luftvejene. I: Ludwig Heilmeyer (hr.): Lærebog i intern medicin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. udgave ibid. 1961, s. 599-746, her: s. 708 ( Diffus progressiv interstitiel lungefibrose : pulmonal fibrose (Hamman-Rich 1944)).
- ↑ a b K. Williams et al.: Identifikation af spontan felint idiopatisk lungefibrose: morfologi og ultrastrukturel dokumentation for en type II pneumocytdefekt. I: Bryst. 125 (6), juni 2004, s. 2278-2288. PMID 15189952 . doi : 10.1378 / bryst.125.6.2278 .
- ^ BM Corcoran et al .: Kronisk lungesygdom i West Highland white terrier. I: Vet Rec. 144 (22), 29. maj 1999, s. 611-616. PMID 16119057
- ↑ LA Cohn et al:. Identifikation og karakterisering af en idiopatisk lungefibrose-lignende tilstand hos katte. I: J Vet Intern Med. 18 (5), sep-okt 2004, s. 632-641. PMID 15515577 . doi : 10.1111 / j.1939-1676.2004.tb02598.x .
- ↑ O. Amann et al.: Kronisk pulmonal interstitiel fibrose i en blåfront Amazon-papegøje (Amazona aestiva aestiva). I: Avian Dis. 51 (1), mar 2007, s. 150-153. PMID 17461284 . doi : 10.1637 / 0005-2086 (2007) 051 [0150: CPIFIA] 2.0.CO; 2 .
- ↑ A. Katzenstein, J. Myers: idiopatisk lungefibrose - kliniske relevans af Patologisk Classification. I: Am J Respir Crit Care Med. 157 (4 Pt 1), apr 1998, s. 1301-1315. PMID 9563754 . doi : 10.1164 / ajrccm.157.4.9707039 .
- ^ R. Collard et al .: Demystificering af idiopatisk interstitiel lungebetændelse. I: Arch Intern Med . 163, 2003, s. 17-29. PMID 12523913 . doi : 10.1001 / archinte.163.1.17 .
litteratur
- J. Müller-Quernheim: Interstitielle lungesygdomme . Thieme, Stuttgart 2001, ISBN 3-13-132281-0 .
- H. Schweisfurth et al: Hvordan diagnosticeres interstitielle lungesygdomme i Tyskland? I: Pneumologi. 57, 2003, s. 373-382. doi: 10.1055 / s-2003-40557