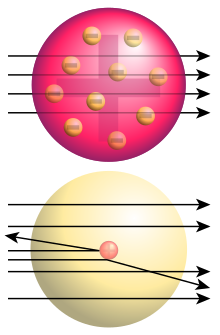
Rutherfords atommodel
Den Rutherford atommodel er en model af atomet , der blev oprettet af Ernest Rutherford mellem 1909 og 1911 . Det danner grundlaget for nutidens billede af atomet ved at indføre atomkernen , der som en ekstremt lille, positivt ladet kugle i atomets centrum har næsten hele sin masse. Så Rutherfords atommodel overvandt den i 1904 opførte Thomsons atommodel og tjente til gengæld i 1913 som udgangspunktet for atomets Bohr -model , atomskallens energiniveauer kunne beskrives for første gang med succes.
oversigt
Indtil Rutherford -spredningsforsøget (1909) af Hans Geiger , Ernest Marsden og Ernest Rutherford var det kun kendt, at atomer indeholder negativt ladede elektroner og den samme mængde positive ladninger . Et passende forsøg på at forklare atomstrukturen var Thomsons atommodel , ifølge hvilken hvert atom består af en ensartet fordelt positiv ladning, hvor elektronerne bevæger sig under virkningen af elektrostatiske kræfter. Rutherford -spredningstesten viste, at denne model ikke repræsenterer virkeligheden. Helheden af atomets positive ladninger og praktisk talt hele dets masse skal kombineres i en atomkerne, hvis størrelse kun er en lille brøkdel af det samlede atom.
Forsøget
Rutherfords kolleger Hans Geiger og Ernest Marsden udførte eksperimenter med højenergi- alfapartikler fra den naturlige radioaktivitet af vismut-214 . Oprindeligt blev det observeret, at et par af alfapartiklerne blev kastet tilbage fra en platinplade . Det var helt uventet, for indtil nu var kun nedbøjninger af alfapartiklerne med få grader blevet bestemt, og det kunne ikke forklares med tidligere ideer om atomet.
I et raffineret eksperimentelt setup blev frekvensfordelingen af afbøjningsvinkler mellem 15 ° og 170 ° undersøgt i et vakuum med tynde folier af forskellige metaller, herunder guld. Også her blev det vist, at afbøjningsvinklerne var væsentligt større, end det kan forklares ved sammenstødet mellem alfapartiklerne med de forholdsvis meget lette elektroner, og at omkring en ud af 8000 alfapartikler blev kastet helt tilbage.
"Det var næsten lige så utroligt, som hvis du affyrede en 15-tommer skal mod et stykke silkepapir, og det kom tilbage og ramte dig."
"Det var næsten lige så utroligt, som hvis du skød et stykke silkepapir med en 15-tommer kugle, og kuglen kom tilbage og ramte dig."
Rutherford modellen
Fra den nyopfattede idé om, at der er en lille, tung, elektrisk ladet kerne i atomet, udledte Rutherford den spredningsformel, der er opkaldt efter ham . Dette kan forklare den observerede frekvens for store afbøjningsvinkler, hvis kernen ikke er større end 1/3000 af atomradius og dens elektriske ladning (i enheder af elementær ladning) svarer omtrent til atomatomnummeret.
For at forklare atomernes elektriske neutralitet antog Rutherford, at kernen er positivt ladet og er omgivet af elektroner, svarer antallet af atomnummer . Der kunne ikke udledes yderligere oplysninger om elektronernes rumlige fordeling, da elektronerne på grund af deres lave masse ikke bidrager til afbøjningen af alfapartiklerne ved store vinkler. I modsætning til hvad der ofte findes i lærebøger og andre sekundære kilder, udviklede Rutherford ikke sin egen model for atomernes elektroniske struktur. I februar 1911, da han præsenterede sin model for Manchester Literary and Philosophical Society, citerede han Nagaokas " planetmodel " for at gøre sit skøn over atomnummeret for guld sandsynlig.
Models grænser
Ifølge Rutherfords model ville elektronerne gå i kredsløb om kernen på Kepler -baner, som ligesom i planetsystemet kunne have enhver ekspansion, excentricitet og orientering. Disse baner kunne imidlertid ikke være stabile, fordi en cirkulerende og dermed accelereret ladning konstant udstråler energi i henhold til love for elektrodynamik . En elektron, der falder ned i kernen, ville generere elektromagnetiske bølger af enhver frekvens, men dette modsiger observation af spektrale linjer med specifikke frekvenser afhængigt af atomtypen.
Individuelle beviser
- ↑ Jörn Bleck-Neuhaus: Elementarpartikler . Fra atomerne til standardmodellen til Higgs boson. 2., revideret udgave. Springer, 2013, ISBN 978-3-642-32578-6 , ISSN 0937-7433 , s. 49 , doi : 10.1007 / 978-3-642-32579-3 .
- ^ Hans Geiger, Ernest Marsden: On a Diffuse Reflection of α-Particles . I: Proceedings of the Royal Society . 82A, 1909, s. 495-500. Hentet 25. oktober 2010.
- ^ Edward Andrade : Rutherford og atomets natur. Doubleday New York 1964. Citeret fra: Laylin K. James: Nobelpristagere i kemi, 1901-1992 , s. 57
- ↑ a b E. Rutherford, Spredningen af α- og β -partikler ved stof og atomets struktur , Fil. Mag. 6, bind. 21, 669-688 (1911). Rutherfords artikel i Philosophical Magazine (engelsk, PDF; 233 kB)
- ↑ Hantarō Nagaoka: Kinetik i et partikelsystem, der illustrerer linjen og båndspektret og fænomenerne i radioaktivitet . I: Filosofisk magasin . 7, 1904, s. 445-455. Hentet 28. februar 2010.