Islet celle transplantation

Den øcelletransplantation eller ø-celletransplantation , i forskning og klinisk praksis delvis forkortet som ITX , er en kirurgisk terapier til behandling af insulinafhængig diabetes mellitus . Under denne behandling implanteres patienten med celleklynger kaldet øer af Langerhans fra bugspytkirtlen hos organdonorer , normalt i blodkarret i leveren . I klinisk praksis er implantation minimalt invasiv ved hjælp af interventionel radiologi , i eksperimentel forskning udføres den undertiden også ved hjælp af konventionel kirurgi .
Ud over overførslen af en komplet bugspytkirtel, kendt som bugspytkirteltransplantation , er ø-celletransplantation i øjeblikket den eneste terapeutiske metode, der, hvis det lykkes, frigør de behandlede patienter fra behovet for regelmæssig ekstern insulinforsyning . Det kommer tættest på at kurere insulinafhængig diabetes mellitus. Derudover kan en holmecelletransplantation også udføres som en såkaldt autolog transplantation, dvs. som en transplantation af kroppens eget væv hos patienter, hvis bugspytkirtlen er fjernet på grund af svær pancreatitis ( betændelse i bugspytkirtlen). Genoverførsel af holme efter fjernelse af det betændte omgivende væv forhindrer forekomsten af diabetes mellitus i denne situation.
På grund af visse bivirkninger og ulemper samt manglende viden om de langsigtede virkninger betragtes ø-celletransplantation stadig som en eksperimentel terapi. Fra 1974 til august 2002 blev 583 transplantationer registreret over hele verden, 493 af dem efter 1990. Antallet af udførte transplantationer er steget markant siden 1999 og var mellem 1999 og 2005 593 kun i Nordamerika.
Baggrundsinformation
Langerhans-øerne
- Hovedartikel: Langerhans Islands
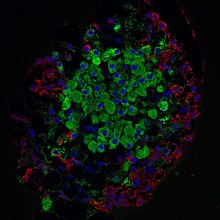
Fluorescensmikroskopi :
grøn - beta-celler
rød - alfa-celler
blå - cellekerner
Langerhans-øerne er kompakte og afgrænsede grupper af celler med en diameter på 50 til 500 mikrometer , som er fordelt i bugspytkirtlen. De kan påvises immunokemisk i mikroskopiske vævspræparater og således på grund af deres farve, der afviger fra det omgivende væv eller ved immunhistokemiske markeringer. Øerne består hver af omkring 1000 til 2000 celler . Omkring 60 til 80 procent af disse er insulinproducerende betaceller . Derudover er der alfa-celler (15 til 20 procent) på øerne, der frigiver glucagon , antagonisten for insulin. Der forekommer desuden delta-celler, PP-celler og EC-celler, som somatostatin , bugspytkirtelpolypeptid eller serotonin , motilin og substans P danner.
Betacellernes opgave er at frigive det blodsukkersænkende hormoninsulin, som reguleres af blodsukkerniveauet og hormonet glukagon. Langerhans-øerne har et tæt netværk af kapillærer (små blodkar). På grund af en særlig struktur muliggør disse kontakt mellem blodet og holmcellerne og dermed den direkte reaktion på blodsukkeret ved at frigive bugspytkirtelhormonerne i blodet.
En sund voksen bugspytkirtel indeholder omkring en million øer af Langerhans med en samlet masse på 1 til 1,5 gram, hvilket er omkring to til fire procent af bugspytkirtlen. Helheden af alle øer i bugspytkirtlen kaldes også endokrin bugspytkirtel eller ø-organet , da øerne adskiller sig markant med hensyn til deres funktion fra resten af bugspytkirtlen, den såkaldte eksokrine bugspytkirtel . Jobbet med det eksokrine væv i bugspytkirtlen er at producere fordøjelsesenzymer .
Indikationer for en transplantation
- Hovedartikel: Diabetes mellitus
Målet med holmecelletransplantation er at genoprette fysiologisk insulinproduktion hos diabetespatienter. Et tab af kroppens egen insulinproduktion er kendt som en absolut insulinmangel og kan have forskellige årsager.
Type 1-diabetes, der rammer omkring 90 procent af primært insulinafhængige diabetikere, skyldes den autoimmunologiske ødelæggelse af betacellerne. I type 2-diabetes er der derimod to forskellige mekanismer for eksistensen af insulinafhængighed afhængigt af sygdommens varighed. På den ene side, hvis der er tilstrækkelig eller endda øget insulinproduktion af kroppens beta-celler, kan kroppens cellers reaktion på insulinet reduceres. Denne tilstand er kendt som insulinresistens eller relativ insulinmangel og er ikke en indikation for holmecelletransplantation. I den sene fase af type 2-diabetes kan betacellerne også ødelægges sandsynligvis på grund af kronisk overbelastning som følge af langvarige forhøjede niveauer Insulinproduktion. Som ved type 1-diabetes resulterer dette i en absolut insulinmangel, til behandling af hvilken en holmecelletransplantation grundlæggende er en mulighed under visse betingelser.
Den eksokrine del af bugspytkirtlen påvirkes ikke af sygdommen hos diabetikere og er derfor normalt sund. En eneste transplantation af øerne er derfor et muligt alternativ til at overføre en komplet bugspytkirtel til behandling af insulinafhængig diabetes mellitus. Isletcelletransplantation er også en mulighed for ikke-diabetespatienter, der skal fjerne bugspytkirtlen på grund af svær betændelse i den eksokrine del ( pancreatitis ). Ved at implantere kroppens egne holme kunne den uundgåelige udvikling af en diabetisk metabolisk situation vendes.
I den nuværende praksis er de vigtigste målgrupper til holmecelletransplantation diabetespatienter med nyresvigt, der kræver dialyse, og diabetikere, der allerede har modtaget en nyretransplantation, samt patienter med ustabil diabetes med hyppig svær hypoglykæmi, eller som er mindre opmærksomme på symptomerne på hypoglykæmi. I princippet ville en holmecelletransplantation være en mulighed for alle patienter med en absolut insulinmangel. De nuværende udelukkelseskriterier, såsom dem, der er fastlagt i Giessen-protokollen, begrænser udvælgelsen af patienter til en lille gruppe type 1-diabetikere. Disse kontraindikationer indbefatter for eksempel en alder under 18 eller mere end 65 år, en manifestationsalder efter 35 år, en varighed af diabetes på mindre end 10 år og tilstedeværelsen af fedme eller insulinresistens.
Praktiske aspekter
Udførelse af transplantationen
Der er etableret forskellige standardiserede regler for udvinding og implantation af øerne og er blevet optimeret gennem årene, for eksempel Edmonton-protokollen eller Giessen-protokollen. For det første er det nødvendigt at isolere holme fra donorens bugspytkirtel, en proces, der tager i alt fire til seks timer. For at gøre dette fordøjes bugspytkirtelvævet enzymatisk ved hjælp af collagenase . Øerne adskilles derefter ved densitetsgradientcentrifugering . Tidligere blev holmene regenereret ved at dyrke dem i en cellekulturblanding i en bestemt periode , men dette trin udelades i nyere protokoller.
Den faktiske implantation, der udføres ved hjælp af interventionel radiologi og tager mindre end en time, hvis processen er som planlagt, finder sted på en minimalt invasiv måde under lokalbedøvelse ved injektion i portalvenen i leveren. Under infusionen af øerne i omkring 200 ml medium overvåges trykket i portalvenen for at detektere en trombose i det vaskulære system i leveren forårsaget af øerne og om nødvendigt afslutte transplantationen for tidligt. Med blodbanen fordeles øerne i leverkarrene og forbliver der. Leveren har indtil videre vist sig at være bedre end andre implantationssteder, især med hensyn til tilførsel af næringsstoffer og reaktionen på blodsukkeret. Indtil videre er mindst 6.000 holme blevet transplanteret pr. Kg legemsvægt. Med indførelsen af Edmonton-protokollen er et antal på 10.000 øer blevet standarden. Der antages såkaldte øækvivalenter, dvs. en gennemsnitlig diameter på 150 mikrometer.
Implantationen ville i princippet være mulig på ambulant basis . Som det ser ud, følger der dog et hospitalsophold på syv til ti dage for at overvåge og undersøge de øjeblikkelige virkninger. I perioden umiddelbart efter transplantationen udføres traditionel insulinbehandling oprindeligt for at lægge så lidt stress på øerne som muligt under indvoksningsfasen. Som det er sædvanligt med andre organtransplantationer, vælges modtageren og donoren i henhold til specifikke vævskarakteristikker i ø-celletransplantationer for at opnå den størst mulige match. Indtil 1999 blev holmecelletransplantationer udført i næsten alle tilfælde i kombination med en nyretransplantation , enten som en samtidig transplantation af holmecellerne og nyrerne eller efter en tidligere nyretransplantation. Siden 1999 er andelen af transplantationer uden ledsagende nyretransplantation steget markant.
Fordele og fordele
Sammenlignet med transplantation af en komplet bugspytkirtel tilbyder holmecelletransplantation to store fordele.
På den ene side er metoden på grund af den minimalt invasive injektionsteknik meget lettere at gennemføre end en bugspytkirteltransplantation . Den kirurgiske indsats og risikoen for visse kirurgiske komplikationer er betydeligt lavere, fordi der f.eks. Ikke skal forbindes blodkar og ingen kanaler mellem kroppen og det nye organ, som det er tilfældet med overførslen af en komplet bugspytkirtel. Hvis øer er implanteret alene uden en ledsagende nyretransplantation, åbnes bukhulen ikke. Frem for alt reducerer dette risikoen for alvorlig blødning og infektion . Flere behandlinger i tilfælde af tab af øernes funktion såvel som en trinvis implantation for optimal justering af antallet af øer er forholdsvis lette.
En anden fordel i forhold til bugspytkirteltransplantation er, at holmecelletransplantation kun erstatter væv, der ikke længere fungerer tilstrækkeligt. Mængden af eksogent væv og dermed også sandsynligheden for forekomst af tilsvarende immunologiske komplikationer reduceres således. Patientens eksokrine bugspytkirtelvæv påvirkes ikke af en mulig fiasko af ø-implantatet på grund af en afstødningsreaktion , mens hvis en komplet bugspytkirtel afvises, ville dets eksokrine funktion også gå tabt. Den såkaldte transplantationspankreatitis (engelsk graftpankreatitis ) gælder ikke for en holmecelletransplantation. Dette er en betændelse i det eksokrine væv i en transplanteret bugspytkirtel, som forekommer hos næsten alle patienter i en midlertidig og mild form. Hos omkring 10 til 15 procent af de berørte er der dog mere alvorlig, langvarig eller gentagen betændelse, hvilket også kan føre til et tab af funktion.
Hvis det lykkes, fører holmecelletransplantation til fuldstændig frigørelse af patienten fra behovet for ekstern insulin og konstant blodsukkerkontrol. Derudover vurderes en signifikant reduktion i insulinbehov og hyppigheden af forekomst af metaboliske komplikationer som delvis succes. Den største fordel sammenlignet med behandling med regelmæssige blodsukkermålinger og tilførsel af insulin baseret på dette er, at insulinforsyningen fra de implanterede øer og den resulterende blodsukkerregulering i det væsentlige svarer til kroppens egne øers funktion i en sund bugspytkirtel.
Ulemper og bivirkninger
Den største ulempe ved holmecelletransplantation, som med alle organtransplantationer, er behovet for permanent at undertrykke den afstødningsreaktion, som kroppens immunsystem udsender mod det eksogene væv. For at gøre dette skal patienter regelmæssigt tage såkaldte immunsuppressiva , dvs. lægemidler, der svækker immunresponset. Den immunsuppressive behandling øger modtageligheden for infektioner og risikoen for visse kræftformer på mellemlang og lang sigt . Erfaringen hidtil har vist, at en yderligere ulempe er, at det med de nuværende tilgængelige immunsuppressiva i de fleste tilfælde ikke er muligt fuldstændigt at undertrykke den autoimmune proces, der førte til ødelæggelsen af kroppens egne holme. Derudover forringer nogle etablerede immunsuppressiva, såsom steroider , rapamycin og calcineurininhibitorer, såsom tacrolimus eller ciclosporin, øernes funktion eller effekten af insulin. Denne effekt, kendt som diabetes mellitus efter transplantation , er også kendt fra andre organtransplantationer, og afhængigt af den aktive ingrediens er den baseret på en reduktion i frigivelsen af insulin fra beta-cellerne, en stigning i insulinresistens , en stigning i apoptose-hastigheden af beta-cellerne, direkte toksicitet over for ø-cellerne eller en kombination af disse effekter. Derudover er negative bivirkninger på nyrerne kendt for disse lægemidler, som begrænser anvendeligheden af holmecelletransplantation hos patienter med intakt nyrefunktion.
Fra et metodologisk synspunkt er udbyttet af holme ikke optimalt med de nuværende isolationsprotokoller. Normalt er der behov for to til tre bugspytkirtler for at opnå det antal øer, der er nødvendige for en holmecelletransplantation. I kun nogle få tilfælde har patienten haft succes med insulin efter transplantation af øer fra et enkelt donororgan. Da der af forskellige årsager udføres forholdsvis få pancreas-transplantationer, fører det i øjeblikket ikke til begrænsninger i tilgængeligheden af donororganer. Imidlertid står dette problem i vejen for en større anvendelse af holmecelletransplantation.
På grund af det lille antal holmecelletransplantationer, der er udført over hele verden til dato, er der stadig ingen pålidelige fund om langtidseffekter og terapeutiske fordele. Dette vedrører især spørgsmålet om, hvorvidt transplantationen forlænger patientens liv eller reducerer hyppigheden og sværhedsgraden af diabetiske komplikationer i det sene stadium, og om den potentielle terapeutiske fordel berettiger de risici og bivirkninger, der er forbundet med immunsuppressiv behandling. Spørgsmålet om, i hvilket omfang holmecelletransplantation kan have en negativ effekt på yderligere organtransplantation, er heller ikke endnu afklaret. Derudover er der utilstrækkelig information om de langsigtede virkninger på patientens lever. Tilstedeværelsen af øerne i leverkarrene resulterer for eksempel i øget tryk i portalvenen og i leverens vaskulære system.
Ud over de specifikke risici ved transplantation, der skyldes immunsuppressiv behandling, er der også risici forbundet med enhver kirurgisk behandling med holmecelletransplantation, såsom uforudsigelige bivirkninger af narkotika, sårinfektioner og intern blødning fra skader. Selvom disse risici er signifikant lavere på grund af den minimalt invasive implementering under lokalbedøvelse end for eksempel med en bugspytkirteltransplantation, ville de ikke være til stede ved konventionel livslang behandling gennem ekstern administration af insulin. Der er cost-benefit-analyser af holmecelletransplantation (f.eks. Beckwith et al. 2012 og Wallner et al. 2016). De samlede omkostninger ved en transplantation anslås til at være omkring $ 76.000 til $ 150.000 sammenlignet med en årlig pris på omkring $ 3.500 pr. Patient om året til intensiv insulinbehandling. Indtil videre er der imidlertid ingen erfaring med omkostningerne ved yderligere tiltag, der kræves, der kan skyldes begge terapeutiske muligheder ved langvarig brug, såsom til behandling af sene diabetiske komplikationer.
Historisk information og udsigter
Medicinsk historie med holmecelletransplantation
Den første eksperimentelle overførsel af bugspytkirtelvæv blev præsenteret den 18. december 1891 af Oskar Minkowski i en forelæsning. Han havde transplanteret fragmenter af bugspytkirtlen under underlivet i en hund, der var blevet diabetiker efter fjernelse af bugspytkirtlen. Allerede den 20. december 1893 forsøgte lægen Patrick Watson-Williams sammen med en kollega på Royal Infirmary Hospital i Bristol for første gang en tilsvarende operation på en person. De transplanterede tre stykker af bugspytkirtlen fra et nyslagtet får til en 15-årig dreng med type 1-diabetes. På trods af en midlertidig forbedring af diabetessymptomerne døde drengen et par dage senere sandsynligvis på grund af den hyperakutte afstødning af dyrevævet og dermed tabet af dets funktion. Den første vellykkede humane bugspytkirteltransplantation blev udført i 1966 af Richard Lillehei ved University of Minnesota. Med hensyn til den mulige fordel viste klinisk anvendelse af metoden oprindeligt sig imidlertid at være uacceptabel hos mindre end tre procent af patienterne på grund af en dødelighed på omkring 60 procent og en funktion af transplantationen efter et år, således at der blev udført yderligere forskning i den følgende periode. Indtil omkring 1990 blev pancreas-transplantation betragtet som en eksperimentel terapi. Siden da er det også blevet udført i klinisk praksis under visse betingelser, men ikke så ofte som andre organtransplantationer . Som det var tilfældet med holmecelletransplantation indtil 1999, udføres det i de fleste tilfælde i kombination med en nyreoverførsel; 75 procent finder sted parallelt med en nyretransplantation og 15 procent bagefter.
Efter succeser med holmetransplantation i eksperimentelle studier på rotter i begyndelsen af 1970'erne blev det antaget, at holmecelletransplantation ville erstatte bugspytkirteltransplantation i klinisk praksis i den nærmeste fremtid. Disse resultater blev muliggjort af udviklingen af en metode til effektiv isolering af holme fra bugspytkirtelvævet i 1967, som blev forbedret af forskellige forskere i de følgende år. Den første vellykkede holmecelletransplantation hos rotter blev udført i 1972. Et år senere blev det vist, at implantation i det vaskulære system i leveren var fordelagtig i forhold til transplantation i bughulen. De første kliniske undersøgelser begyndte så tidligt som i 1974, men ingen af patienterne nåede målet om uafhængighed af eksternt tilført insulin. I 1977 i Minneapolis blev der for første gang udført såkaldte allogene transplantationer af autologe holme hos patienter, hvis bugspytkirtlen var fjernet på grund af svær pancreatitis. Behandlingen forhindrede diabetes mellitus i at forekomme. I 1990 blev effektiviteten af allotransplantation efter terapeutisk fjernelse af bugspytkirtlen demonstreret i en vellykket klinisk serie i Pittsburgh. Succesgraden for denne behandling er omkring 70 procent, den langsigtede funktion af transplantationen og dermed fraværet af insulin er mere end 20 år hos nogle patienter.
En anden vigtig milepæl på vej til klinisk anvendelse til behandling af diabetes mellitus var udviklingen af en metode til automatiseret isolering af humane holme i 1986. Den første vellykkede holmecelletransplantation hos en diabetespatient blev udført fire år senere på Washington University Medical Center i St. Louis. Den 26. november 1992 blev den første vellykkede transplantation i området Eurotransplant udført ved universitetet i Giessen . Syv år senere indførte Edmonton-protokollen en ny behandlingsstrategi, hvis effektivitet og overlegenhed blev demonstreret af syv på hinanden følgende vellykkede transplantationer i 2000, hvor alle patienter var insulinfrie i mindst et år. Som et resultat af forbedringerne forbundet med Edmonton-protokollen steg andelen af patienter, der kunne klare sig uden ekstern insulinadministration et år efter transplantationen fra omkring otte procent til omkring 50 procent hos dem, der blev behandlet efter 1999. Stigningen i udbyttet og dermed antallet af implanterede øer på grund af den nye protokol samt afkald på visse immunsuppressiva ved brug af en kombination af tacrolimus og sirolimus og den midlertidige anvendelse af det terapeutiske antistof daclizumab umiddelbart efter transplantationen bidrog især til dette . Den første holmecelletransplantation baseret på en levende donation, hvor holme blev overført til en 27-årig kvindelig patient fra sin sunde 56-årige mor, blev udført den 19. januar 2005 på Kyoto Universitetshospital.
Statistik og forskning
På universitetet i Giessen har der været et internationalt register for holmecelletransplantationer ( International Islet Transplant Registry , ITR) siden begyndelsen af 1990'erne . Cirka 95 procent af alle transplantationer udført over hele verden rapporteres om dette. Ifølge disse data blev 583 holmecelletransplantationer udført over hele verden fra 1974 til august 2002. Af disse fandt 493, omkring 85 procent, sted efter 1990, antallet steg fra 27 i 1990 til 69 i 2002. Patienternes etårige overlevelsesrate var 96 procent. I omkring 40 procent af tilfældene var funktionen af de transplanterede øer stadig detekterbar efter et år, og målet om insulinuafhængighed blev opnået hos omkring hver fjerde patient. Det længste registrerede tilfælde af at være insulinfrit var seks år i 2003.
Med indførelsen af Edmonton-protokollen i 1999 var der en betydelig stigning i antallet af transplantationer. I Nordamerika alene blev der udført i alt 593 holmecelletransplantationer med 319 patienter mellem 1999 og 2005, inklusive mere end 100 transplantationer om året siden 2002. Antallet af aktive centre, der udfører mindst en transplantation om året, er også steget markant til 31 i Nordamerika i denne periode. En anden tendens er, at andelen af patienter med første holmecelletransplantationer er stigende og har været omkring halvdelen af alle registrerede tilfælde siden 2003. Antallet af transplantationer uden ledsagende nyretransplantation er også steget til omkring 89 procent. Ud over Giessen inkluderer de førende centre i Europa for denne metode Milano og Genève , i USA Minneapolis , Miami , Pittsburgh og St. Louis og i Canada Edmonton .
Imidlertid er de fleste patienter ikke længere insulinfrie fem år efter transplantationen. Hos omkring 80 procent af de behandlede har øerne dog stadig restfunktion efter dette tidspunkt, hvilket i det mindste fører til en forbedret blodsukkerkontrol med en reduceret forekomst af hypoglykæmi. Hovedårsagerne til den hidtil kun begrænsede succes med holmecelletransplantation er sandsynligvis hovedsagelig i kroniske afstødningsreaktioner og genudseende af autoimmuniteten, der er ansvarlig for ødelæggelsen af kroppens egne holme. Derudover spiller virkningerne af immunsuppressive midler på øerne også en rolle, ligesom øernes udmattelse også spiller øerne. Denne effekt opstår, fordi de resterende betaceller, når øerne dør ud, bliver mere og mere stressede.
Forskning for at optimere holmecelletransplantation fokuserer derfor på flere områder. På den ene side gøres forsøg på at forbedre isolationsudbyttet og opnå et forhold på ”et donororgan, en modtager” for at være i stand til at transplantere flere holme på denne måde. Ud over leveren undersøges andre implantationssteder for deres egnethed og mulige fordele, især med hensyn til afskærmning mod immunologiske reaktioner og dermed øernes langvarige overlevelse. Ved at indkapsle øerne med forskellige biomaterialer , skal beskyttelse mod afstødningsreaktioner og autoimmune processer opnås. At reducere bivirkningerne af immunsuppressiva ved at optimere terapi og udvikle nye, specifikt effektive lægemidler er også en vigtig del af forskningen.
Mulige alternativer til transplantation af holme fra donororganer, som i øjeblikket befinder sig i forskningsfasen, inkluderer anvendelse af dyreøer som en del af en såkaldt xenotransplantation eller transplantation af stamceller eller betaceller dyrket af stamceller. Derudover undersøges stimuleringen af regenerering af betaceller i patientens bugspytkirtel såvel som den genetiske manipulation af patientens egne leverceller for at stimulere dem til at producere, opbevare og blodsukkerkontrolleret frigivelse af insulin (såkaldt PDX-1 leverceller). En dyremodel, der anvendes af metodologiske grunde til visse forskningsaspekter, er brugen af øvæv fra fisk , da denne er kompakt i form af den såkaldte Brockmann-krop og derfor er let at isolere.
Individuelle beviser
- Sen Alp Sener, Matthew Cooper, Stephen Bartlett: Er der en rolle for transplantation af bugspytkirtlen i type 2-diabetes mellitus? I: transplantation . 90 (2) / 2010, s. 121-123
- ↑ Reinhard Bretzel, Daniel Brandhorst, Heide Brandhorst, Michael Eckhard, Wolfgang Ernst, Schirin Friemann, Wigbert Rau, Bernd Weimar, Klaus Rauber, Bernhard Hering, Mathias Brendel: Forbedret Overlevelse af intraportal Bugspytkirtelkræft Islet Cell Allotransplantater hos patienter med type-1 diabetes mellitus af Refined Peritransplant Management. I: Journal of Molecular Medicine . 77, 1999, s. 140-143.
- ↑ a b A.M. James Shapiro, Jonathan RT Lakey, Edmond Ryan, Gregory Korbutt, Ellen Toth, Garth Warnock, Norman Kneteman, Ray Rajotte: Islet Transplantation in seven Patients with Type 1 Diabetes Mellitus using a Glucocorticoid-Free Immunosuppressive Regimen. I: The New England Journal of Medicine 343 (4) / 2000. Massachusetts Medical Society, s. 230-238, ISSN 0028-4793
- ^ A b Elisa Cantarelli, Lorenzo Piemonti: Alternative transplantationssteder for bugspytkirteløtransplantater. I: Aktuelle diabetesrapporter. 11 (5) / 2011. Springer, s. 364-374, ISSN 1534-4827
- ↑ Cinzia Labruzzo, Adil R. El Tayar, Nadey Hakim: Graft Pancreatitis: Literature Review. I: International Surgery. 91 (2) / 2006. Minerva Medica, s. 107-111, ISSN 0020-8868
- ↑ a b c d Mark Naftanel, David Harlan: Pancreatic Islet Transplantation. I: PLoS Medicine 1 (3) / 2004. Det offentlige videnskabsbibliotek, s. E58ff., ISSN 1549-1277
- ↑ George W. Burke III, Francesco Vendrame, Antonello Pileggi, Gaetano Ciancio, Helena Reijonen, Alberto Pugliese: Gentagelse af autoimmunitet efter bugspytkirteltransplantation. I: Aktuelle diabetesrapporter. 11 (5) / 2011. Springer, s. 413-419, ISSN 1534-4827
- ↑ Alfred Penfornis, Stéphanie Kury-Paulin: immunsuppressive lægemiddel-induceret diabetes. I: Diabetes og stofskifte. 32 (5) / 2006. Masson, s. 539-546 ISSN 1262-3636
- ^ A b Shaheed Merani, AM James Shapiro: Aktuel status for pancreatisk øtransplantation. I: Klinisk videnskab. 110/2006. Portland Press, s. 611-625, ISSN 0143-5221
- ^ Oskar Minkowski: Yderligere oplysninger om diabetes mellitus efter udryddelse af bugspytkirtlen. I: Berliner Klinische Wochenschrift. 29/1892, s. 90-94
- W Patrick Watson-Williams: Noter om diabetes behandlet med ekstrakt og af transplantater af fårens bugspytkirtel. I: British Medical Journal 2/1894, s. 1303
- ^ William Kelly, Richard Lillehei, Fred Merkel, Yasumo Idezuki, Frederik Goetz: Allotransplantation af bugspytkirtlen og tolvfingertarm sammen med nyren i diabetisk nefropati. I: Kirurgi. 61 (6) / 1967. Elsevier, s. 827-837, ISSN 0039-6060
- ↑ Paul Lacy, Mery Kostianovsky: Metode til isolering af intakte øer af Langerhans fra rottepankreas. I: Diabetes. 16/1967. American Diabetes Association , s. 35-39, ISSN 0012-1797
- ^ Walter Ballinger, Paul Lacy: Transplantation af intakte bugspytkirteløer hos rotter. I: Kirurgi. 72 (2) / 1972. Elsevier, s. 175-186, ISSN 0039-6060
- ↑ Camillo Ricordi, Paul Lacy, Edward Finke, Barbara Olack, David Scharp: Automatiseret metode til isolering af menneskelige bugspytkirteløer. I: Diabetes. 37/198. American Diabetes Association , s. 413-420, ISSN 0012-1797
- ↑ David Scharp, Paul Lacy, Julio Santiago, Christopher McCullough, Lamont Weide, Luca Falqui, Piero Marchetti, Ronald Gingerich, Allan Jaffe, Philip Cryer, Charles Anderson, M. Wayne Flye: Insulinuafhængighed efter østransplantation i type I diabetespatient. I: Diabetes. 39 / (4) / 1990. American Diabetes Association , s. 515-518, ISSN 0012-1797
- ↑ Shinichi Matsumoto, Teru Okitsu, Yasuhiro Iwanaga, Hirofumi Noguchi, Hideo Nagata, Yukihide Yonekawa, Yuichiro Yamada, Yusuke Nakai, Michiko Ueda, Akemi Ishii, Emi Yabunaka, AM James Shapiro, Koichi Tanaka: Insulin Single Living Uafhængighedserklæringen Efter Ustabil Patient Transplantation af donorøer. I: Transplantationsprocedurer. 37 (8) / 2005. Elsevier Science, s. 3427-3429, ISSN 0041-1345
- ^ ITR - International Islet Transplant Registry; WWW: http://www.med.uni-giessen.de/itr/
- ↑ CITR - Collaborative Islet Transplant Registry of the National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK); WWW: http://www.citregistry.org/
- ↑ Emily Alexander, Kent Dooley, Bill Pohajdak, Bao-You Xu, James Wright Jr.: Ting, vi har lært af Tilapia Islet Xenotransplantation. I: Generel og komparativ endokrinologi. 148 (2) / 2006. Elsevier, s. 125-131, ISSN 0016-6480
litteratur
- Nadey Hakim, Robert Stratta, Derek Gray: Pancreas og Islet Transplantation. Oxford University Press, Oxford og New York 2002, ISBN 0-19-263255-8
- Jonathan Lakey, Mohammadreza Mirbolooki, AM James Shapiro: Nuværende status for klinisk ø-celtransplantation. I: Transplantationsimmunologi - Metoder og protokoller. Serie: Metoder i molekylærbiologi. Bind 333/2006. Humana Press, s. 47-104, ISBN 1-58-829544-3
- Richard Downing: Historisk gennemgang af pancreatisk øtransplantation i: World Journal of Surgery . 8/1984. Société Internationale de Chirurgie, s. 137-142, ISSN 0364-2313
- Mark Naftanel, David Harlan: Pancreatic Islet Transplantation. I: PLoS Medicine 1 (3) / 2004. Det offentlige videnskabsbibliotek, s. E58ff., ISSN 1549-1277
- AN Balamurugan, Rita Bottino, Nick Giannoukakis, Cynthia Smetanka: Fremtidige og udfordringer ved øtransplantation til behandling af autoimmun diabetes. I: bugspytkirtlen. 32 (2) / 2006. Lippincott Williams & Wilkins, s. 231-243, ISSN 0885-3177
Weblinks
- Medline Plus: Islet Cell Transplantation (engelsk)



