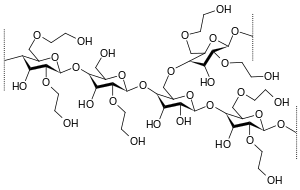
Hydroxyethylstivelse
Hydroxyethylstivelse , forkortet til HES eller HAES (tidligere også: HÄS), er en kunstigt fremstillet polymer . Dens anvendelse som en blodplasmaerstatning ses nu kritisk, efter at HES har været brugt i udstrakt grad i mange år. HES tjener som en kolloid volumenerstatning , der ligesom dextrans og gelatin bruges til at kompensere for intravaskulær volumenmangel.
Baseret på nylige undersøgelser af risk-benefit-forholdet for det anbefalede Pharmakovigilanzausschuss (Pharmacovigilance Risk Assessment Committee, PRAC) fra Det Europæiske Lægemiddelagentur (Det Europæiske Lægemiddelagentur) inkluderede imidlertid tilbagetrækning af markedsføringstilladelse for produkter, der hydroxyethylstivelse den 14. juni, 2013. British Medicines and Healthcare products Regulatory Agency fulgte henstillingen den 27. juni 2013. Den amerikanske fødevare- og lægemiddeladministration udsendte en sort boksadvarsel til HES den 24. juni 2013 . Den Føderale Institut for Narkotika og Medicinsk Udstyr (BfArM) anbefales den 24. juni 2013 "ikke at anvende hydroxyethylstärkehaltiger infusioner" indtil afslutningen af proceduren risikovurdering europæisk.
En ny evaluering foretaget af PRAC, lægemiddelovervågningsafdelingen for EMA, den 12. januar 2018 viste, at begrænsningerne for anvendelse og kontraindikationer inden for intensivmedicin ikke overholdes. PRAC anbefaler derfor at fjerne alle HES-produkter fra markedet i hele Europa. En afgørelse truffet af koordinationsgruppen for gensidig anerkendelse og decentraliserede procedurer - human (CMDh) af lederne af lægemiddelagenturer (HMA) er stadig afventet .
Egenskaber ved HES-blodplasmaerstatninger
HES er lavet af voksagtig majsstivelse eller af kartoffelstivelse . Det består næsten udelukkende af amylopectin , dvs. forgrenede kæder af glukosemolekyler . For at forhindre, at amylopectinet nedbrydes for hurtigt af det endogene enzym amylase , er glucoseenhederne delvist hydroxyethylerede. Denne hydroxyethylering er også nødvendig for at opnå stivelsens vandopløselighed.
Mens i den første generation var den gennemsnitlige molekylstørrelse for det meste 450.000 Dalton, og graden af substitution var 0,7, blev den i anden generation reduceret til 200.000 og 0,5 og i tredje generation til 130.000 og 0,4. I USA er kun den første generation stadig tilgængelig som Hetastarch, mens anden generation som Pentastarch kun er tilgængelig til bestemte applikationer. Dagens moderne HES har ud over en yderligere reduceret molær masse på ca. 130.000 med en substitutionsgrad på 0,4 ikke mere saltopløsning for at opretholde isotonicitet , men en afbalanceret opløsning med acetat.
Handlingsmekanisme
HES er et stort molekylært stof og er i stand til at opretholde det kolloide osmotiske tryk i blodbanen, så væsketabet kan kompenseres til en vis grad, og den givne væske forbliver i blodbanen længere end ren krystalloid infusioner ville.
Den tilstand af handling af HES er baseret på princippet om kolloid osmose. Under normale forhold er der et bestemt onkotisk tryk ( kolloid osmotisk tryk ) i blodet . Albuminer (som kolloider) i blodet er højmolekylære proteiner og sikrer, at væsken forbliver i blodet. Hvis der er volumenmangel, for eksempel på grund af et chok, brydes ligevægten, og væsken passerer fra blodbanen ind i vævet. Indgivelsen af en kolloid opløsning modvirker dette, idet væske trækkes ind i det intravaskulære lumen, men dette kan føre til mangel på væske i vævet ( interstitium ). Derfor kræves der normalt også en fuld elektrolytopløsning.
Brug som en erstatning for volumen
I mange år var HES en del af det basale udstyr i enhver ambulance . Valget af infusionsopløsningen til en akut nødhændelse - hvad enten det er krystalloid, kolloid eller hypertonisk NaCl-opløsning - har været diskuteret i lang tid. Siden 2013 er brugen af HES kun tilladt til akut blødning, der ikke kan behandles forskelligt. Det er ikke længere godkendt til andre indikationer.
Siden da er det kun givet i berettigede enkeltsager. Foruden HES, hvis der mangler interstitiel væske, skal der gives en fuld elektrolytopløsning (tidligere Ringers opløsning , nu med acetat) for at kompensere for hele væskemangel. Med krystalloider har du brug for en større mængde kolloid infusioner til en udskiftning af volumen, såsom. B. HES, men deres uønskede virkninger kan undgås. Brug af HES-infusioner hos forbrændingspatienter i de første 24 timer betragtes kritisk, og den eneste infusion af Ringers lactat eller en elektrolytopløsning foretrækkes, fordi den kolloidale HES-opløsning kan forværre forbrændingsødemet gennem aflejringer i interstitiet.
uønskede effekter
Efter administration af HES kan kløe i huden ( kløe ) forekomme efter et par dage . Dette skyldes sandsynligvis en ophobning af HES i huden. Det er ofte meget vanskeligt at behandle og kan vare i flere måneder.
En enkelt indgivelse af større mængder HES uden yderligere væsker kan føre til en øget koncentration i nyretubuli og til nyreskader på grund af osmosen. Derfor skal HES altid kombineres med tilstrækkelige krystalloide infusioner. Den øgede risiko for nyresvigt og også dødelige konsekvenser af nyreskade er nu blevet bekræftet i yderligere to store undersøgelser.
VISEP-undersøgelsen blev udført på effektiviteten og indikationerne af HES i sepsis. Imidlertid henviser udsagnene i denne undersøgelse til anden generation af HES-varianter (200, 0,4). Til brug af moderne HES-løsninger med lav molekylvægt anbefaler DGAI som en sikkerhedsforanstaltning, at brugen af HES overvejes nøje i hvert enkelt tilfælde og begrænses til patienter med akut livstruende, ellers ukontrollerbart blod- og volumintab.
I en undersøgelse foretaget af det danske Rigshospitalet i København, ledet af Andres Perner, med HES-produktet fra B. Braun, undersøgte Perner og et team af skandinaviske forskere fordele og risici ved det kunstige blodplasma hydroxyethylstivelse (HES) i behandlingen af alvorlig blodforgiftning. Undersøgelsen viste, at patienter med sepsis, i hvem noget af den tabte væske består af HES-infusioner, har en højere risiko for død end dem, der fik en isotonisk opløsning. Nyreskader og svær blødning var også mere almindelige hos HES-patienter. HES-producenten Fresenius Kabi kritiseres for sin aggressive tilgang mod den vildledende navngivning af sit produktnavn i undersøgelsen ved hjælp af lovlige midler efter offentliggørelsen af undersøgelsesresultaterne.
Nylige undersøgelser har ikke vist noget bevis for, at stoffer som HES reducerer risikoen for død hos patienter efter traumer, operationer eller alvorlige forbrændinger. Derudover blev det kendt, at talrige undersøgelser af HES var blevet forfalsket. Den tyske anæstesilæge Joachim Boldt havde offentliggjort omkring 70 specialartikler om hydroxyethylstivelse, for det meste med en positiv vurdering af lægemidlet. Dette svarer til 0,68% af den samlede litteratur om HES. Redaktørerne af 16 internationale tidsskrifter trak adskillige publikationer fra Boldt tilbage, efter at en analyse fra den statslige lægeforening i Rheinland-Pfalz havde vist, at 89 af i alt 102 undersøgelser ikke var godkendt af de etiske komiteer . (se også: Bedrageri og forfalskning inden for videnskab )
Den lægemiddelovervågning -Committee for Risikovurdering (Lægemiddelovervågning Udvalget for Risikovurdering, PRAC) af Europæiske Lægemiddelagentur derfor (Det Europæiske Lægemiddelagentur) anbefales den 14. juni, 2013 tilbagekaldelse af tilladelsen for produkter indeholdende hydroxyethylstivelse markedsføring. Dette blev efterfulgt af British Medicines and Healthcare products Regulatory Agency den 27. juni 2013. Den amerikanske fødevare- og lægemiddeladministration udsendte en sort boksadvarsel til HES den 24. juni 2013 om, at HES ikke skulle anvendes i advarsler om kritiske sygdomme, f.eks. som sepsis , nyredysfunktion og koagulationsforstyrrelser såvel som på intensivafdelinger, da dette kan føre til nyredysfunktion og kraftig blødning. Den 24. juni 2013 anbefalede det tyske forbundsinstitut for lægemidler og medicinsk udstyr (BfArM) at ”afstå fra at bruge infusionsopløsninger indeholdende hydroxyethylstivelse”, indtil den europæiske risikovurderingsproces var afsluttet.
Det Bedømmelsesudvalg Risikovurdering inden for Lægemiddelovervågning (PRAC) anbefales den 11. oktober, 2013, at HES ikke længere bør anvendes i følgende grupper:
- Patienter med sepsis
- Brænd patienter
- kritisk syge patienter
HES bør ikke anvendes i mere end 24 timer, og nyrefunktionen skal overvåges i mindst 90 dage.
I februar 2017 anmodede den offentlige burger.org, en forbrugerbevægelsesorganisation, om et andet forbud mod HES som en del af en borger andragende til FDA og EMA.
Revurderingen fra PRAC, divisionen for lægemiddelovervågning af EMA, som blev offentliggjort den 12. januar 2018, viste imidlertid, at begrænsningerne for anvendelse og kontraindikationer inden for intensivmedicin ikke overholdes. PRAC anbefalede derfor, at alle HES-produkter trækkes tilbage fra markedet i hele Europa. Men den Koordinering gruppe for gensidig anerkendelse og decentrale procedurer - menneske (CMDh) af Heads of Medicines Agencies (HMA) derefter besluttet, at de infusionsvæsker bør fortsat være tilgængelige, forudsat at der træffes yderligere sikkerhedsforanstaltninger. Den 17. juli 2018 godkendte Europa-Kommissionen beslutningen fra CMDh, som derfor er juridisk bindende for alle EU-lande.
HES som et dopingstof i konkurrencesport
HES fik også tvivlsom berømmelse gennem dopingskandalen ved Nordisk verdensmesterskab i 2001 i Lahti, Finland . Derefter var seks finske langrendsløbere , inklusive den olympiske mester og flere verdensmestre Mika Myllylä , idet HES blev demonstreret efter, at agenten tidligere kun havde været et års dopingliste af IOC, sandsynligvis omkring af EPO Doping eller bloddoping øget hæmatokrit og at kompensere for den øgede blodviskositet gennem de positive reologiske egenskaber ved HES. Den præstationsfremmende effekt af HES i sig selv er kontroversiel blandt eksperter.
Individuelle beviser
- ↑ a b Risikovurderingsudvalg inden for lægemiddelovervågning (Pharmacovigilance Risk Assessment Committee, PRAC) fra Det Europæiske Lægemiddelagentur (Det Europæiske Lægemiddelagentur) PRAC anbefaler at suspendere markedsføringstilladelser for infusionsopløsninger indeholdende hydroxyethylstivelse. 14. juni 2013, pressemeddelelse , PDF (71 kB) .
- ↑ a b MHRA suspenderer brug af hydroxyethylstivelse (HES) drypper. ( Memento af 10. august 2014 i webarkivet archive.today ) Pressemeddelelse fra Medicines and Healthcare products Regulatory Agency af 27. juni 2013.
- ↑ a b FDA-sikkerhedskommunikation: Boxed Advarsel om øget dødelighed og alvorlig nyreskade og yderligere advarsel om risiko for blødning ved brug af hydroxyethylstivelsesopløsninger i nogle indstillinger. Meddelelse fra Food and Drug Administration dateret 24. juni 2013.
- ↑ a b Federal Institute for Drugs and Medical Devices (BfArM): Hydroxyethylstivelse (HES): PRAC-anbefaling. ( Memento fra 1. juli 2013 i webarkivet archive.today ) Kommunikation fra 24. juni 2013.
- ES HES-godkendelser skal suspenderes Julia Borsch, DAZ. Online fra 12. januar 2018, adgang til den 14. januar 2018
- ↑ K. Aktories, U. Forstermann, F. Hofmann, K. Starke (red.): Generelle og særlige farmakologi og toksikologi. 9. udgave. Elsevier, München 2005, ISBN 3-437-42521-8 , s. 489.
- ↑ Se H. Köhler: Indflydelse af nyrefunktion på eliminering og virkning af kolloide plasmasubstitutter. I: Fremskridt inden for medicin. Bind 97, 1979, s. 1809-1813.
- ↑ R. Zarychanski, AM Abou-Setta, AF Turgeon et al:.. Foreningen af hydroxyethylstivelse Administration Med Dødelighed og akut nyreskade hos kritisk syge patienter, som kræver Volume Genoplivning: en systematisk gennemgang og meta-analyse. I: JAMA. 309, 2013, s. 678-688, doi: 10.1001 / jama.2013.430
- ^ N. Haase, A. Perner, LI Hennings, M. Siegemund, B. Lauridsen, M. Wetterslev, J. Wetterslev: Hydroxyethylstivelse 130 / 0.38-0.45 versus krystalloid eller albumin hos patienter med sepsis: systematisk gennemgang med metaanalyse og prøve sekventiel analyse. I: BMJ. 346, 2013, s. 346, doi: 10.1136 / bmj.f839
- Rein K. Reinhart et al.: Studieprotokol for VISEP-undersøgelsen - svar fra SepNet-studiegruppen. I: Anæstesilægen. 57, 2008, s. 723-728, doi: 10.1007 / s00101-008-1391-1 . ( online , PDF-dokument; 299 kB)
- ↑ Anders Perner et al.: Hydroxyethylstivelse 130 / 0,42 versus Ringers acetat i svær sepsis. I: N Engl J Med. 367, 2012, s. 124-134, doi: 10.1056 / NEJMoa1204242
- ↑ Nicola Kuhrt: Kontroversiel nødhjælp: lægemiddelvirksomheden presser kritiske forskere. I: Spiegel Online. 27. juli 2012.
- ↑ Kai Kupferschmidt: Emergency Medicine: Death on IV Drip. I: tid online. fra 23. oktober 2012.
- ↑ Veronika Hackenbroch: For godt til at være sandt. I: Spiegel Online . 29. november 2010. (online)
- ↑ Er den kliniske anvendelse af moderne hydroxyethylstivelse løsninger skal nu revurderes? Erklæring fra DGAI-præsidiet den 21. februar 2011. I: Anästh Intensivmed. 52, 2011, s. 173. ( online ( Memento fra 19. december 2013 i internetarkivet ), PDF-dokument; 386 kB)
- ↑ Redaktionens erklæring (PDF-dokument; 139 kB)
- ↑ EMA: Hydroxyethylstivelsesopløsninger (HES) bør ikke længere anvendes til patienter med sepsis eller forbrændingsskader eller til kritisk syge patienter - CMDh støtter PRAC-anbefalinger. EMA-meddelelse
- Es Hes: EU-myndighed begrænser brugen af kontroversielle bloderstatninger. I: Spiegel Online. 11. oktober 2013.
- ↑ Farmakovigilance Committee for Risk Assessment (Pharmacovigilance Risk Assessment Committee, PRAC) fra Det Europæiske Lægemiddelagentur (Det Europæiske Lægemiddelagentur) PRAC bekræfter, at hydroxyethylstivelsesopløsninger (HES) skulderstand ikke længere blev brugt til patienter med sepsis eller forbrændingsskader eller hos kritisk syge patienter . 11. oktober 2013, pressemeddelelse . (PDF)
- ↑ Offentlige borger andragender FDA om at trække nogle IV-løsninger. dateret 8. februar 2017
- ES HES-godkendelser skal suspenderes Julia Borsch, DAZ. Online fra 12. januar 2018, adgang til den 14. januar 2018
- ^ Hydroxyethylstivelse (HES) indeholdende lægemidler. Det Europæiske Lægemiddelagentur (EMA), juli 2018
- ↑ https://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Risikoinformationen/RisikoBewVerf/gl/hes-stufenplanbescheid.pdf?__blob=publicationFile&v=2
- ↑ Karow, Lang-Roth: Generel og speciel farmakologi og toksikologi .