Hückel tilnærmelse
Hückel-tilnærmelsen foreslået af Erich Hückel , også: Hückel molekylær orbitalmodel / -metode (HMO-model / -metode), er en metode til semiempirisk kvantekemi . Deres mest almindelige anvendelse er at tilnærme molekylære orbitaler i konjugerede π-systemer. Det leverer overraskende gode resultater med lidt computerindsats. De to vigtigste konsekvenser er Hückel-reglen og Woodward-Hoffmann-reglerne .
Ansøgning
Tilnærmelsen er afledt af Ritzs metode ved anvendelse af basis af atomære p-orbitaler. Egenværdiproblemet reduceres formelt til . I det første tilfælde er en egenfunktion af molekylet Hamilton-operatøren . For at bestemme det nøjagtigt skulle en 6n- dimensionel partiel differentialligning blive løst for et n- atomisk molekyle , som analytisk dvs. Generelt ikke muligt. I det andet tilfælde er den n -dimensionelle vektor, der indeholder koefficienterne for lineær kombination.
Efter at den er beregnet, kan den molekylære orbitale gives som en tilsvarende lineær kombination af de individuelle pz- orbitaler. Værdien E repræsenterer orbitalens energi.
I Ritz-metoden findes den bedst mulige løsning iterativt ved hjælp af Hartree-Fock-metoden . Til dette skal et stort antal integraler løses i hvert trin, hvilket betyder en høj beregningsindsats. Forenklingen af Hückel-tilnærmelsen er, at alle integraler er parametrerede.
De n konjugerede atomer i molekylet nummereres fortløbende. Matricen er en n × n matrix. Man sætter:
h ii = α i
h ij = β , hvis de to atomer er tilstødende (og forbundet ved konjugering), og
h ij = 0 ellers.
α i er Coulomb-integralet af atomet i i molekylet ( α i <0 )
(* er den komplekse bøjning, V betegner hele bindet)
β er resonansintegralet mellem to atomer i , j (antages at være den samme for alle atompar) ( β <0 )
Pointen med tilnærmelsen er, at disse to integraler ikke beregnes. For eksempel kan de estimeres ved hjælp af empiriske data. For to atomer af samme art sidestilles Coulomb-integralerne. Det er derfor særligt let at beregne rene kulbrinter. Der er kun to konstanter α og β tilbage. Egenvektorerne er uafhængige af deres værdi.
Afledning af Hückel-reglen
De Frost cirkel tilbyder en enkel måde at estimere stabiliteten af cyklisk konjugerede plane molekyler. Det er baseret på den overraskende kendsgerning, at energiniveauet i et cyklisk konjugeret plan n-atommolekyle kan repræsenteres som et regelmæssigt n hjørne (forudsat at planetmolekylet har en n- fold hovedrotationsakse).
A n ring svarende n × n matrix dannes ved i hovedsagen diagonale a skrivninger, ind i de to sekundære diagonaler p og også i den nederste venstre og det øverste højre hjørne af β :
Egenværdierne for denne matrix er givet af . Hvis du nu anvender energien langs y -aksen, skal du være opmærksom på, at β er negativ og holde de tilsvarende afstande i x- retning, får du et opadvendt n -gon.
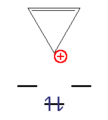
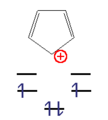
- Eksempler på aromatiske forbindelser
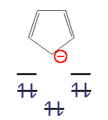
Dette n hjørne kan nu udfyldes med et ulige antal elektronpar ( 4n + 2 π elektroner) med en høj forstærkning i energi. Disse molekyler kaldes " aromater ". Med et lige antal elektronpar ( 4n π-elektroner) ville de to øverste niveauer være halvt besat ifølge Hunds regel , molekylet ville være paramagnetisk og den samlede energiforøgelse ville være lille. Disse forbindelser er ustabile og kaldes "anti-aromater".
- Eksempler på anti-aromatiske forbindelser
eksempel
benzen
Hückel-matrixen er:
Egenværdierne stammer fra:
Egenvektorerne for de respektive egenværdier:
((1, 1, 1, 1, 1, 1), (1, 0, -1, -1, 0, 1), (-1, -1, 0, 1, 1, 0), (-1 , 1, 0, -1, 1, 0), (-1, 0, 1, -1, 0, 1), (-1, 1, -1, 1, -1, 1))
Et afsnit (parallelt med xy-planet i en afstand på 75 pm) gennem de tilsvarende orbitaler vises til højre. Koordinaterne for vektorerne betyder hver for sig tegnet på p z- bølgefunktionerne. Disse tælles mod uret fra højre.
Ifølge en opadvendt sekskant er der 3 stabiliserede og tre destabiliserede orbitaler. 6 elektroner kan derfor optage de nedre tre orbitaler med høj energiforøgelse. Den samlede bindingsenergi er 2 · 2 β + 4 β = 8 β . Denne værdi er signifikant højere end 6 β for tre isolerede π-bindinger.
svulme
- Peter W. Atkins: Fysisk kemi . Weinheim [u. a.]: VCH-Verl.-Ges.
- Dietmar Dorninger: Matematiske grundlæggende for kemikere . Eisenstadt: Prugg
litteratur
G. Frenking: Perspektiv på ”Kvanteteoretiske bidrag til benzenproblemet. I. Den elektroniske konfiguration af benzen og relaterede relationer ” . I: Teoretisk kemi . bånd 103 , 2000, s. 187-189 , doi : 10.1007 / s002149900023 .