Glatirameracetat
| Strukturel formel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Generel | |||||||||
| Efternavn | Glatiramer | ||||||||
| andre navne |
|
||||||||
| CAS-nummer |
|
||||||||
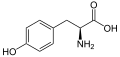
| Monomerer / delstrukturer | L - alanin , L - glutaminsyre , L - lysin , L - tyrosin | ||||||||
| Molær massestimering |
5.000 til 9.000 dalton |
||||||||
| PubChem | 3081884 | ||||||||
| Type polymer | |||||||||
| ATC-kode | |||||||||
| DrugBank | DB05259 | ||||||||
| Narkotikainformation | |||||||||
| Narkotikaklasse | |||||||||
| ejendomme | |||||||||
| Sikkerhedsinstruktioner | |||||||||
| |||||||||
| Så vidt muligt og sædvanligt anvendes SI-enheder . Medmindre andet er angivet, gælder de givne data for standardbetingelser . | |||||||||
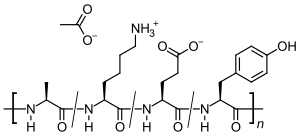
Glatirameracetat ( GA ) er eddikesyresaltet ( acetat ) af et syntetisk produceret polypeptid, der indeholder de fire naturligt forekommende aminosyrer L - alanin , L - glutaminsyre , L - lysin og L - tyrosin i tilfældig rækkefølge. Det immunmodulatoriske stof anvendes som et lægemiddel til behandling af recidiverende multipel sklerose (MS). Den nøjagtige virkningsmekanisme er ukendt. Da sammensætningen af Glatiramer ligner de komponenter, der bruges til at isolere nerveceller , siges det at reducere de inflammatoriske reaktioner i centralnervesystemet, der forekommer i MS .
En glatirameracetatopløsning til injektion blev først markedsført af Teva i USA i 1996 som Copaxone . Det blev godkendt i EU i 2001.
Klinisk information
Godkendte anvendelsesområder
Glatirameracetat reducerer antallet af tilbagefald hos ambulante patienter med recidiverende multipel sklerose . Det forhindrer dog ikke handicapprogression hos patienter med MS. Glatirameracetatbehandling har heller ikke vist sig at reducere varigheden eller sværhedsgraden af et angreb.
I EU er glatirameracetat godkendt til behandling af recidiverende multipel sklerose.
- Reduktion af tilbagefaldsfrekvensen hos ikke-hjælpede patienter med recidiverende remitterende multipel sklerose (MS). I kliniske forsøg var dette karakteriseret ved mindst to tilbagefald af neurologisk dysfunktion i de sidste to år.
- Behandling af patienter med en veldefineret første klinisk episode, der har høj risiko for at udvikle klinisk etableret multipel sklerose. Denne yderligere indikation - behandling af endnu uafklaret MS - blev godkendt i 2009.
Der er ingen godkendelse for de primære eller sekundære progressive former for MS.
De begrænsede offentliggjorte data antyder, at sikkerhedsprofilen hos unge 12 til 18 år, der får glatirameracetat 20 mg subkutant dagligt, er sammenlignelig med den hos voksne.
Ansøgningstype og varighed
Glatirameracetat injiceres subkutant , dvs. i subcutis , dagligt eller tre gange om ugen, afhængigt af det aktive indholdsstof i de fyldte sprøjter . Behandling af MS kræver langvarig brug.
uønskede effekter
Lokale hudreaktioner såsom rødme, forbrænding, kløe eller hærdning af det tilsvarende område af det subkutane væv er mest almindelige. Disse kan afhjælpes ved at afkøle injektionsstedet før og efter injektionen.
En bivirkning kendt som SPIR (Immediate Post Injection Reaction) eller “flush” kan sjældent forekomme af en uforklarlig årsag. Umiddelbart efter injektionen i kort tid (ca. 5 til 15 minutter) er der åndenød, angst, følelse af frygt, svedtendens, hurtig hjerterytme og derefter kulderystelser og hovedpine. Symptomerne aftager gradvist i løbet af de tolv timers periode.
Undersøgelser
Begyndelser
I 1977 gennemførte Weizmann Institute de første åbne undersøgelser af den aktive ingrediens hos mennesker. Oprindeligt på fire patienter med fremskreden multipel sklerose efterfulgt af fire patienter med tilbagevendende MS og tolv med kronisk progressiv sygdom. Resultaterne var opmuntrende nok til at gå i gang med et randomiseret kontrolleret forsøg .
Planlægningen af denne pilotundersøgelse blev udført af Murray B. Bornstein (1917-1995) fra 1966 indtil hans pensionering i 1988 fakultetsmedlem af Albert Einstein College of Medicine i New York City . Undersøgelsens primære endepunkt var at bestemme, i hvilket omfang patienterne ville forblive tilbagefaldsfrie. Sekundære endepunkter var hyppigheden af forværringer og graden af handicap i slutningen af undersøgelsen. 50 patienter med tilbagevendende MS blev randomiseret, og undersøgelsen blev afsluttet med 48 deltagere. Da der var for lidt information om Cop-1's stabilitet, fik patienterne præparatet i frossen tilstand, tillod den daglige ration at tø op og injicerede det selv (efter at de var blevet trænet i overensstemmelse hermed) en gang dagligt i to år. Under disse forhold modtog 23 patienter placebo (saltvand) og 25 patienter fik Cop-1. Resultaterne blev offentliggjort i 1987 i NEJM . I placebogruppen var der 62 forværringer, i verumgruppen var der 16. Mens graden af handicap i placebogruppen forværredes med 1,2 enheder, forbedredes graden af handicap i verumgruppen med 0,5 enheder.
I 1996 introducerede United States Adopted Name Council i Chicago navnet Glatiramer , hvorved de første bogstaver i de fire involverede aminosyrer og slutningen "-mer" (stående for polymer) blev brugt til at navngive det internationale ikke-proprietære navn for at overholde organisationens retningslinjer for enkle og forståelige vilkår, der skal matches.
Klinisk effekt ved tilbagevendende MS
I godkendelsesundersøgelsen med 251 patienter over en behandlingsperiode på to år kunne en reduktion i tilbagefaldsprocenten på ca. 30% påvises sammenlignet med placebo.
En langsigtet undersøgelse, der kom frem fra registreringsundersøgelsen, har vist, at tilbagefaldsprocenten fortsætter med at falde over en længere observationsperiode. De nuværende 15-årige data fra den åbent gennemførte prospektive undersøgelse fortsætter denne udvikling. Tilbagefaldsprocenten blev reduceret fra ca. 1,2 tilbagefald pr. År inden behandlingsstart med mere end 80 procent til ca. 0,2 tilbagefald pr. År hos de patienter, der havde modtaget GA i mere end 15 år. Samtidig havde terapien en positiv effekt på det neurologiske handicap: 57 procent af de patienter, der kontinuerligt var blevet behandlet med GA, havde en stabil eller forbedret værdi på EDS-skalaen efter 15 år. Denne skala giver information om graden af handicap, som en MS-patient har. Mere end 80 procent forblev under en EDS-værdi på 6, hvilket betyder, at de var i stand til at gå mindst 100 meter alene uden gåhjælpemiddel. Hos de patienter, der havde stoppet behandlingen for tidligt og blev undersøgt 10 år efter behandlingsstart, var handicapgraden forblevet stabil eller kun forbedret i 28 procent af tilfældene. Det skal bemærkes, at antallet af deltagere i opfølgningsperioden for oprindeligt 232 personer, der havde modtaget glatirameracetat mindst en gang, kun 100 patienter fortsatte behandlingen efter femten år. Af de 124 patienter, der droppede tilbage, vendte 50 tilbage til behandlingsklinikken til opfølgende undersøgelse af undersøgelsen efter 10 år. Det kan antages, at det primært var de mennesker, der forlod undersøgelsen, i hvem GA fungerede mindre godt, i det mindste en del af den signifikant lavere tilbagefaldsrate skulle være relateret til dette. På den anden side kan folk også nægte at deltage i undersøgelsen, hvis deres symptomer tillader dem at undertrykke deres diagnose.
Resultaterne af en metaanalyse fra tre placebokontrollerede dobbeltblindede undersøgelser bekræfter den positive effekt af GA på tilbagefaldshastigheden. Som en del af de kliniske undersøgelser blev der fundet en reduktion i den årlige tilbagefaldsprocent på 28 procent hos dem af de i alt 540 forsøgsdeltagere, der blev behandlet med præparatet sammenlignet med dem, der kun modtog et narkotika. Derudover blev tiden til det første angreb øget ved behandling med GA (322 dage versus 219 dage med placebo). Risikoen for, at graden af handicap stiger markant, var også lavere under GA, selvom den informative værdi af analysen er begrænset på dette punkt på grund af den relativt korte varighed af undersøgelserne (24, 35 og 9 måneder).
I en åben undersøgelse blev den terapeutiske succes for GA og standard beta-interferoner hos patienter med recidiverende MS sammenlignet med tilbagevirkende kraft. Til dette formål blev data fra 308 patienter evalueret, som kom fra en database, hvor det toårige behandlingsforløb er dokumenteret: Efter seks måneders behandling var interferoner og GA sammenlignelige i deres effektivitet med hensyn til at reducere antallet af angreb . Efter 12 og 24 måneder var der ingen forskelle mellem interferonpræparaterne. I løbet af denne periode reducerede behandlingen med GA imidlertid antallet af angreb betydeligt mere end med nogen af de undersøgte interferoner. Derudover var frafaldsprocenten lavere blandt GA. Det skal bemærkes om denne undersøgelse, at den informative værdi af resultaterne - på grund af undersøgelsens design - er begrænset.
I tre andre aktuelle undersøgelser - REGARD, BEYOND og BECOME - blev forskellige beta-interferonpræparater og GA sammenlignet med hinanden. I løbet af de randomiserede undersøgelser, hvor i alt mere end 3000 patienter med tilbagevendende MS var involveret, blev der fundet en tilsvarende god effektivitet for interferoner og GA med hensyn til tid til første tilbagefald, tilbagefaldshastighed og antallet af aktive læsioner i CNS.
Klinisk effekt ved primært progressiv MS
En nylig, kontrolleret klinisk undersøgelse undersøgte effektiviteten af GA på primær progressiv MS, hvor der ikke er nogen tilbagefald, men snarere symptomerne udvikler sig kronisk fra starten. I løbet af undersøgelsen var der ingen signifikant effektivitet af terapien på progressionen af hele undersøgelsespopulationen. Den samlede progression var imidlertid lavere end forventet, hvilket nedsatte undersøgelsens gyldighed. I modsætning hertil viste resultaterne af en retrospektiv analyse en klar behandlingseffekt på den mandlige subpopulation af undersøgelsen, hvor progressionen var på det oprindeligt forventede niveau.
Neurobeskyttende effekt
Den neurobeskyttende virkning af GA kunne også vises i en MR-baseret undersøgelse. Antallet af læsioner, der passerer fra arrede betændelsescentre til irreversibel axonal skade - såkaldte "sorte huller" - kunne halveres med administrationen af GA. Den beskyttende virkning af GA får dog først virkning efter en behandlingsperiode på ca. seks måneder.
Resultaterne af en undersøgelse foretaget af Omar Khan viser også, at GA hæmmer tabet af nervevæv. Han behandlede 18 tilbagefaldende MS-patienter med GA i seks år fra sygdommens indtræden. Andre patienter forblev oprindeligt ubehandlet. Regelmæssige målinger af den neurale markør N-acetylaspartat (NAA) ved anvendelse af magnetisk resonansspektroskopi (MRS) viste, at forholdet mellem NAA og kreatin steg markant hos de behandlede patienter . Dette antyder igen en genopretning i aksonal funktion og beskyttelse mod axonal skade. Hos de ubehandlede patienter faldt NAA / creatin-forholdet derimod signifikant, det vil sige et betydeligt tab af axoner blev fundet hos disse patienter. Dette forbedredes efter start af terapi. Mange patienter udvikler antistoffer mod glatirameracetat; deres kliniske betydning er imidlertid ukendt.
Handlingsmekanisme
Hvordan glatirameracetat er i stand til positivt at påvirke forløbet af MS er ikke blevet afklaret med sikkerhed; følgende mulige handlingsmekanismer drøftes i øjeblikket:
- GA's kemiske struktur svarer meget til den for myelinbasisk protein (MBP) - især sekvensafsnit 82 til 100 - en hovedkomponent i myelinlaget . Cellulær fragmentering i individuelle epitoper omdanner GA til peptider, der også har en høj affinitet for MHC klasse I og MHC klasse II kompleks på dendritiske celler . I modsætning til MBP er T-celle-receptoren, som er komplementær til MHC, imidlertid ikke en agonist , men en antagonist .
- Desuden GA forårsager et skift i forholdet mellem T H 1 til T H 2 immunceller ( T-hjælper-celler ). De aktiverede TH2 - celler krydser blod-hjerne-barrieren og frigiver i stigende grad antiinflammatoriske cytokiner ( interleukin-4 , IL-6 og interleukin-10 ) i CNS . Samtidig reduceres produktionen af proinflammatoriske cytokiner, såsom IL-12. Dette fører til undertrykkelse af de patologiske inflammatoriske processer i MS-læsionen på stedet. Derudover er dannelsen af neurotrofiske faktorer, f.eks. B. the Brain Derived Neurotrophic Factor (BDNF), fremmet med en mulig neurobeskyttende virkning - tabet af axoner kan derved hæmmes, og det ødelagte myelinlag kan genopbygges.
- GA fremmer udviklingen af regulerende CD8-immunceller, som normalt er signifikant reduceret hos ubehandlede MS-patienter.
- Ved at aktivere transkriptionsfaktoren FOXP3 ( forkhead box protein 3 ) fremmer GA omdannelsen af konventionelle CD4 + CD25- T-celler til CD4 + CD25 + regulatoriske T-celler .
ejendomme
Glatiramer er en heterogen blanding af syntetiske polypeptider . Disse består af fire naturlige aminosyrer glutaminsyre , lysin , alanin og tyrosin ("GLAT"), som er til stede i et fast molforhold på 0,14: 0,34: 0,43: 0,09. Den gennemsnitlige molære masse af eddikesyresaltet glatirameracetat (GA) er 5.000 til 9.000 Dalton .
Strukturelle formler af aminosyrerne indeholdt i peptidet og salt-tidligere eddikesyre (acetat):
Da glatirameracetat tilfældigt polymeriseres fra de fire aminosyrer, det indeholder, og som kun er til stede i et bestemt forhold, skal effektiviteten af hver batch , der sælges, først kontrolleres i dyreforsøg.
Stoffet er et af de ikke-biologiske komplekse lægemidler .
Andre oplysninger
historie
I 1960'erne, Michael Sela og Ruth Arnon gennemført flere serier af eksperimenter på Weizmann Institute i Israel, som havde til formål at tydeliggøre de minimale kemiske krav et molekyle skal have for at udløse en immunreaktion i den organisme, dvs. bly til dannelse af antistoffer . Derudover bør der fremsættes udsagn om, hvordan immunreaktionernes specificitet kommer til . Til dette formål blev gelatine udstyret med korte peptider med forskellige sammensætninger, hvorved gelatins immunogenicitet kunne øges signifikant, hvis der blev tilsat tyrosin, tryptophan , phenylalanin eller - her i mindre grad - cystein , mens en kovalent binding af peptider , alanin, lysin, glutaminsyre , Serin og prolin var ikke tilfældet. Senere indså de, at peptidkomponenterne og ikke gelatinen var ansvarlige for de immunogene egenskaber, og at sådanne syntetisk producerede molekyler fra 4000 Dalton er potente antigener . Derefter blev der også syntetiseret et polypeptid, der skulle svare til myelinbasisk protein (MBP ) for at udløse eksperimentel autoimmun encephalomyelitis (EAE) hos forsøgsdyr , dvs. en autoimmunreaktion mod MBP.
Der blev produceret tre polypeptider, som blev dannet ved copolymerisation og derfor blev benævnt copolymerer.
Selvom ingen af de producerede polypeptider kunne provokere EAE, blev det i stedet observeret og offentliggjort i 1971, at EAE blev undertrykt i de indenlandske marsvin, der blev brugt i disse testserier . I dette tilfælde viste alle tre copolymerer denne beskyttende virkning, når hjælp fra Freunds adjuvans , en stærk immunstimulerende og irriterende adjuvans , administreret intradermalt . Kun copolymer-1 viste en effekt efter intravenøs injektion med saltopløsning . Denne enkleste af de tre copolymerer havde også de færreste bivirkninger. Copolymer-1 eller Cop-1 for kort , som holdt dette arbejdsnavn indtil 1996, bør derfor være afgørende for videreudvikling.
Som et resultat kunne det påvises, at denne beskyttende virkning ikke var begrænset til individuelle dyrefamilier og var uafhængig af typen af trigger anvendt til EAE.
Som Stanley Scheindlin siger, var forskerne nu overbeviste om, at de i stedet for et farmakologisk middel havde fundet et potentielt lægemiddel. Yderligere prækliniske undersøgelser af stoffets sikkerhed fulgte med forsøgsdyr ( mus , rotter , kaniner og beagles ), der blev administreret forskellige doser i forskellige tidsperioder.
Den kommercielle udnyttelse af forskningsresultaterne succeser og godkendelse under navnet Copaxone fandt sted i 1996 i USA og i november 2001 for alle medlemslande i EU af selskaberne TEVA og Sanofi-Aventis , så det var tilgængelig i Østrig fra Januar 2002 f.eks. Navnet Copaxone refererer også til stoffets udviklingshistorie: 'Cop' for copolymer, 'ax (on)' for nerve (ensystem) og 'one' for (copolymer) 1.
Handelsnavne og doseringsformer
- Copaxone ( Teva Pharma )
- Glatopa ( Sandoz Inc., USA)
- Glatiramyl (BGP Products GmbH, CH )
Opløsning i fyldte sprøjter til subkutan injektion
omkostninger
De årlige omkostninger i 2011 beløb sig til 11.600 EUR (kilde: omkostningsliste for Øvre Østrigs regionale sundhedsforsikringsfond OÖGKK)
Weblinks
- Detaljeret videnskabelig diskussion af GLT's virkningsmekanisme (Engl.)
- Stanley Scheindlin: Copolymer 1: An Off-Beat Drug Development Story ( PDF ). Om udviklingshistorikken for Copaxone. I: Molekylære interventioner, 2014
- Barbara Peruche, Martin Schulz: Glatirameracetat til behandling af multipel sklerose , Pharmazeutische Zeitung, udgave 34/2002.
Individuelle beviser
- ↑ Dette stof er enten endnu ikke klassificeret med hensyn til dets farlighed, eller der er endnu ikke fundet en pålidelig og citabel kilde.
- ↑ a b Copaxone-specialistoplysninger pr. Februar 2009.
- ↑ en b c d e S. Scheindlin: Copolymer 1: en off-beat lægemiddeludvikling historie. I: Molekylære interventioner. Bind 4, nummer 1, februar 2004, s. 6-9, doi : 10.1124 / mi.4.1.6 . PMID 14993470 .
- ↑ MB Bornstein, A. Miller et al:. En pilot forsøg med Cop 1 i forværring-remitterende multipel sklerose. I: The New England Journal of Medicine . Bind 317, nummer 7, august 1987, s. 408-414, doi : 10.1056 / NEJM198708133170703 . PMID 3302705 .
- ^ CC Ford et al.: En prospektiv open-label undersøgelse af glatirameracetat: over et årti med kontinuerlig brug i multipel sklerose. I: Multipel sklerose. 12, 2006, s. 309-320.
- ^ CC Ford et al.: Kontinuerlig langtidsimmunmodulatorisk terapi ved tilbagefaldende multipel sklerose: Resultater fra 15-årig analyse af den amerikanske prospektive open-label-undersøgelse af Glatirameracetat. I: Multipel sklerose. 14, 2008, s.41.
- ↑ FM BONESCHI et al:. Virkninger af glatirameracetat på attakfrekvensen og akkumuleret handicap i dissemineret sklerose: meta-analyse af tre dobbeltblinde, randomiserede, placebo-kontrollerede kliniske forsøg. I: Multipel sklerose 9, 2003, s. 349-355.
- ↑ J. Haas et al.: Fireogtyve måneders sammenligning af immunmodulatoriske behandlinger - en retrospektiv open label-undersøgelse hos 308 RRMS-patienter behandlet med beta-interferoner eller glatirameracetat (Copaxone) . I: European Journal of Neurology. 12, 2005, s. 425-431.
- ↑ JS Wolinsky et al.: Glatirameracetat i primær progressiv multipel sklerose: resultater af et multinationalt, multicenter, dobbeltblindt, placebokontrolleret forsøg. I: Ann Neurol. 61, 2007, s. 14-24.
- ↑ M. Filippi et al.: Glatirameracetat reducerer andelen af nye MS-læsioner, der udvikler sig til "sorte huller". I: Neurologi. 57, 2001, s. 731-733.
- ^ O. Khan et al.: Axonal metabolisk opsving og potentiel neurobeskyttende virkning af glatirameracetat ved tilbagefald-remitterende multipel sklerose. I: Mult Scler. 11, 2005, s. 646-651.
- ↑ O. Khan et al.: Langsigtet evaluering af neuronal metabolisme ved recidiverende-remitterende multipel sklerose: kombinerede resultater fra to kohorter af glatirameracetatbehandlede patienter undersøgt prospektivt med seriel hjerneproton magnetisk resonansspektroskopi (1H-MRS) . I: Sammendrag præsenteret på det 18. møde i European Neurological Society ENS. 7.-11. Juni 2008 i Nice
- ^ Cohen BA, Oger J, Gagnon A, Giovannoni G. Implikationerne af immunogenicitet for proteinbaseret multipel skleroseterapi. J Neurol Sci. 2008; 275, 7-17, PMID 18822434
- ↑ R. Aharoni, D. Teitelbaum et al:. Copolymer 1 virker mod den immunodominante epitop 82-100 af myelin basisk protein ved T-celle-receptorantagonisme foruden større histokompatibilitetskompleks blokering. I: PNAS . Bind 96, nummer 2, januar 1999, s. 634-639, PMID 9892685 . PMC 15188 (fri fuldtekst).
- ↑ M. Ruggieri, C. Avolio et al:. Glatirameracetat i dissemineret sklerose: en anmeldelse. I: CNS Drug Reviews . Bind 13, nummer 2, 2007, s. 178-191, doi : 10.1111 / j.1527-3458.2007.00010.x . PMID 17627671 . (Anmeldelse).
- ↑ C. Farina, MS Weber et al:. Glatirameracetat i dissemineret sklerose: opdatering på potentielle virkningsmekanismer. I: The Lancet Neurology . Bind 4, nummer 9, september 2005, s. 567-575, doi : 10.1016 / S1474-4422 (05) 70167-8 , PMID 16109363 .
- ↑ J. Hong, N. Li et al:. Induktion af CD4 + CD25 + regulerende T-celler ved copolymer-I ved aktivering af transkriptionsfaktor Foxp3. I: Proceedings of the National Academy of Sciences i Amerikas Forenede Stater . Bind 102, nummer 18, maj 2005, s. 6449-6454, doi : 10.1073 / pnas.0502187102 . PMID 15851684 , PMC 1088385 (fri fuldtekst).
- ↑ Ordineringsoplysninger , copaxone.com (PDF, Eng.).
- ↑ Glatirameracetat ( Copaxone tørt stof; Aventis) ; Farmaceutisk avis , nummer 51/2001.
- Sel M. Sela, S. Fuchs, R. Arnon: Undersøgelser på den kemiske basis af proteinernes antigenicitet. 5. Syntese, karakterisering og immunogenicitet af nogle multikæder og lineære polypeptider indeholdende tyrosin. I: Den biokemiske journal. Bind 85, oktober 1962, s. 223-235, PMID 13992690 . PMC 1243934 (fri fuld tekst).
- ↑ D. Teitelbaum, A. Meshorer et al:. Undertrykkelse af eksperimentel allergisk encephalomyelitis ved en syntetisk polypeptid. I: European Journal of Immunology. Bind 1, nummer 4, august 1971, s. 242-248, doi : 10.1002 / eji.1830010406 . PMID 5157960 .
- ↑ D. Teitelbaum, C. Webb et al:. Suppression af flere syntetiske polypeptider eksperimentel allergisk encephalomyelitis induceret i marsvin og kaniner med bovin og human basisk encephalitogenet. I: European Journal of Immunology. Bind 3, nummer 5, maj 1973, s. 273-279, doi : 10.1002 / eji.1830030505 . PMID 4128127 .
- ↑ D. Teitelbaum, C. Webb et al:. Undertrykkelse af eksperimentel allergisk encephalomyelitis i rhesusaber med et syntetisk basisk copolymer. I: Klinisk immunologi og immunopatologi. Bind 3, nummer 2, november 1974, s. 256-262, PMID 4141659 .
- ↑ ANDA: 090218