Aldehyder
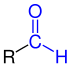
Aldehyder (fra neo-latinsk al coholus dehyd rogenatus, "dehydreret alkohol " eller "alkohol, hvorfra hydrogen er fjernet") er kemiske forbindelser med den funktionelle gruppe –CHO, også kendt som aldehydgruppen eller formylgruppen. I modsætning til ketonerne har aldehydernes carbonylgruppe ( > C = O) et hydrogen og en carbonsubstituent. Den enkleste aldehydmethanal ( formaldehyd ), som har to hydrogensubstituenter , er en undtagelse . Aldehyder med en alkylgruppe ( dvs. alkanderivater ) kaldes alkanaler ; deres homologe serie stammer nomenklaturligt fra den homologe serie alkaner. Der er også flere aldehyder - såsom glyoxal , det enkleste dialdehyd.
nomenklatur
Ifølge IUPAC- nomenklaturen får aldehyder navnet på alkanen med det samme antal kulstofatomer med suffikset -al eller -carbaldehyd. Følgelig kaldes aldehydet afledt af methan methanal , ethanalet afledt af ethan . Hvis en anden funktionel gruppe har en højere prioritet, anvendes præfikset “Formyl-”. Hvis forbindelsen på den anden side er et naturligt stof eller en carboxylsyre, vælges præfikset ”Oxo-”.
Det almindelige navn er afledt af det latinske navn for den carboxylsyre, der oprettes, når der tilføjes et iltatom . For methanal (H - CHO) dette er methansyre (latin acidum formular icum, H - COOH), dermed danne aldehyd, for ethanal det er ethansyre (Latin acidum acet icum, CH 3 COOH), dermed acetaldehyd . De andre trivielle navne er afledt i overensstemmelse hermed. Dicarboxylsyrer, hvor en carboxylsyregruppe er blevet reduceret til en aldehydgruppe, kaldes undertiden semialdehyder .
Homolog serie af alkanalerne
| Antal (kulstofatomer) |
IUPAC navn |
Almindelige navne | Molekylær formel | Strukturel formel |
Kogepunkt i ° C |
|---|---|---|---|---|---|
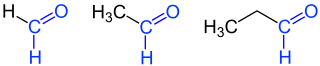
| 1 | Methanal | formaldehyd | CH 2 O | −19.1 | |
| 2 | Ethanal | acetaldehyd | C 2 H 4 O | 20.1 | |
| 3 | Propanal | propionaldehyd propylaldehyd |
C 3 H 6 O | 48 | |
| 4. plads | Butanal | n- butyraldehyd | C 4 H 8 O | 74.8 | |
| 5 | Pentanal | Valeraldehyd amylaldehyd n- pentaldehyd |
C 5 H 10 O | 103 | |
| 6. | Hexanal | Capronaldehyd n- hexaldehyd |
C 6 H 12 O | 131 | |
| 7. | Heptanal | Enanthaldehyd heptyl n- Heptaldehyd |
C 7 H 14 O | 152,8 | |
| 8. plads | Octanal | Caprylaldehyd n- octylaldehyd |
C 8 H 16 O | 171 | |
| 9 | Nonanal | Pelargonaldehyd n- nonylaldehyd |
C 9 H 18 O | 191 | |
| 10 | Decanal | Capric aldehyd n- decylaldehyd |
C 10 H 20 O | 208,5 | |
| 12. | Dodecanal | laurinaldehyd dodecyl |
C 12 H 24 O | 238 | |
| 14. | Tetradecanal | Myristylaldehyd tetradecylaldehyd |
C 14 H 28 O | 260 |
Den almene formel for de alkanaler er C n H 2 n O ( n = 0, 1, 2, 3, 4, ...).
Der er også mange andre grupper af aldehyder, som historiske navne mest bruges til:
- Acrolein er afledt af propen - en alken .
- Benzaldehyd er afledt af benzen , så det er et arylaldehyd.
- Furfural (furfural, furan-2-carbaldehyd) stammer fra furan og er derfor et heteroarylaldehyd.
ejendomme
Dipol-dipol kræfter opstår mellem aldehydgrupperne af alkanaler , da C = O dobbeltbinding er meget polær. Der dannes ikke hydrogenbindinger, fordi der ikke er noget iltbundet hydrogenatom. Derfor er aldehydes kogepunkter mellem alkoholer og alkaner. Aldehyder kan danne hydrogenbindinger med vand, fordi oxygenatomet har to frie elektronpar og er negativt polariseret. Derfor er kortkædede aldehyder let opløselige i vand. I tilfælde af langkædede aldehyder dominerer virkningen af de ikke-polære alkylradikaler, hvilket gør forbindelserne uopløselige i vand. Mange aldehyder har en karakteristisk lugt.
Hændelse
Aldehyder anvendes i vid udstrækning som aromaer i fødevarer såsom vin . Ofte opstår disse i frugt og grøntsager fra stoffer, der indeholder oliesyre , linolsyre eller linolensyre under høst, hakning eller tilberedning. Hexanal kan findes f.eks. B. i æbler, pærer, ferskner og kirsebær. ( E ) -2- hexenal findes i æbler, ferskner, kirsebær og blommer, det isomere ( Z ) -2-hexenal findes i æbler, pærer, appelsiner og jordbær. ( Z ) -3-Nonenal forekommer i agurker ud over ( E , E ) -2,4-Nonadienal, ( E , Z ) -2,6-Nonadienal og ( Z , Z ) -3,6-Nonadienal som en lugtgivende smag.
Over en bestemt koncentration klassificeres sådanne carbonylforbindelser imidlertid ofte som harsk, fiskeagtig, metallisk eller som paplignende aromaer og forårsager generelt en gammel smag.
Fremstilling
Den milde oxidation af primære alkoholer i et ikke-vandigt medium producerer aldehyder. De kan yderligere oxideres til carboxylsyrer .
- Ethanol reagerer med kobberoxid i en redoxreaktion til dannelse af acetaldehyd , kobber og vand .
Den teknisk vigtigste proces til fremstilling af aldehyder er oxosyntese , også kendt som hydroformylering . En alken omsættes med en blanding af carbonmonoxid og hydrogen i nærværelse af en egnet katalysator:

|
| Hydroformyleringen af en alken producerer en blanding af n -aldehyd (mellem) og i -aldehyd (til højre). |
brug
Formaldehyd (methanal) produceres i store mængder (21 millioner tons på verdensplan om året) mere end noget andet aldehyd. Det bruges som et desinfektionsmiddel, som konserveringsmiddel for letfordærvelige varer såsom kosmetik (formalinopløsning) og som råmateriale i den kemiske industri. De største mængder blev forarbejdet til aminoplaster og phenoplaster i plastindustrien indtil 1990 . I medicin anvendes methanal i en 4-8% opløsning (formalin) som fiksativ i histoteknologi .
Aldehyder og ketoner bruges også til at fremstille plast , opløsningsmidler , farvestoffer , tanniner , parfume og medicin. Startende fra acrolein , DL -methionin, en fodertilsætningsstof , der produceres i mængder på mere end 100.000 tons om året.
I medicin anvendes formaldehyd og glutaraldehyd som overflade- og instrumentdesinfektionsmidler. Begge aldehyder er effektive mod mange forskellige mikroorganismer . Især kan ikke-indkapslede vira og sporedannende bakterier (f.eks. Miltbrand ), som kun er tilgængelige for et par desinfektionsmidler, nås på denne måde. Da aldehyder har en irriterende virkning på huden og slimhinderne og lejlighedsvis forårsager allergier, skal disse midler anvendes omhyggeligt.
I parfumeriet anvendes aldehyder siden 1921 ( Chanel nr. 5 ).
Fysiologisk betydning
Et antal aldehyder findes i metabolismen af celler. En særlig rolle spilles af acetaldehyd (ethanal), der produceres i løbet af nedbrydningen af ethanol og er involveret i udviklingen af den såkaldte alkohol-tømmermænd .
bevis
Aldehyde spektroskopi
I IR-spektrene af aldehyder og ketoner finder man det intense karakteristiske bånd for C = O-strækningsvibration i intervallet 1690–1750 cm -1 .
I 13 C-NMR-spektre, er signalet af carbonylcarbonatomet af aldehyder og ketoner fundet i et område på 195 og 210 ppm. Den tilsvarende proton i aldehydgruppen kan findes i 1 H-NMR-spektre som en skarp signal ved ca. 10 ppm. Denne egenskab gør identifikation ved hjælp af NMR-spektroskopi særlig let, da kun få protoner har en resonans i dette høje område.
Reaktioner
Aldehyder er reaktive forbindelser og kan let oxideres til carboxylsyrer .
- C = O-bindingen af carbonylgruppen er stærkt polær med den delvise positive ladning (δ +) på carbonatomet, som kan angribes af nukleofiler .
- Aldehyder med et hydrogenatom bundet til α-carbonatomet direkte ved siden af carbonylgruppen kan være i keto- eller enolform - se keto-enol-tautomerisme .
- I tilfælde af aldehyder observeres det, at hydrogenatomer på carbonatomet støder op til carbonylgruppen er signifikant surere end hydrogenatomer på "normale" carbonatomer. På den ene side skyldes dette, at carbonylcarbonet har meget ringe elektroner og har en -I-effekt på nabobindinger. På den anden side kan den negative ladning efter deprotonering delokaliseres på carbonylets ilt gruppe ( −M effekt ).
Nukleofil tilsætning
Efter at nukleofilen er angrebet, går π- elektronparet helt til iltet , som nu er negativt ladet . I det protiske opløsningsmiddel kompenseres dette for ved optagelse af protoner, som skaber en OH-gruppe i stedet for carbonylgruppen.
Tilsætning af vand
Vand + aldehyd ⇒ aldehydhydrat ( geminal diol )
I vandig opløsning er aldehyder i ligevægt med den tilsvarende gemdiol , dvs. et carbonhydrid med to hydroxylgrupper på et carbonatom. Normalt er ligevægten på siden af aldehydet. I tilfælde af trichloracetaldehyd er ligevægten imidlertid på siden af geminal diol.
Tilsætning af alkoholer
Alkohol + aldehyd ⇒ hemiacetal
Hemiacetal + alkohol ⇒ acetal + vand
Eksempel: ringlukning af druesukker (glukose)
Se også: acetaldannelse
Tilsætning af kvælstofnukleofiler
Prim. Amin + aldehyd ⇒ imin (Schiff-base) + vand
Sek. Amin + aldehyd ⇒ enamin + vand
Oxidation til carboxylsyre (vigtigt for bevis)
Aldol-reaktion
CH-surt H- atom i a- position kan opdeles med baser . Den resulterende enolatanion føjer til carbonylcarbonet i et andet aldehydmolekyle. Resultatet er en aldol , et additionsprodukt af alkohol (OH-gruppe) og aldehyd. På denne måde kan der oprettes CC-obligationer. Hvis aldol dannes derefter dehydreret, kaldes det aldolkondensation , hvilket resulterer i α, β-umættede aldehyder.
Blandet aldolreaktion
Blandede aldolreaktioner kan normalt ikke udføres i en en-pot-reaktion, da fire mulige produkter kan og dannes. En undtagelse er, når en af de to aldehyder ikke kan enoliseres, dvs. ikke har et CH-surt hydrogenatom. I dette tilfælde er kun en blandet aldol mulig. Et eksempel på ikke-enoliserbare aldehyder er aromatiske aldehyder (se: Benzaldehyd ). På denne måde opnås cinnamaldehyd , en vigtig duft , i en Knoevenagel-kondens .
Pinacol kobling
Substituere aldehyder med et alkalimetal (fx natrium ) på en måde, danner en gruppe - anion , den dimeriseret hurtigt. Hydrolysen producerer en pinacol (traditionelt navn for en 1,2- diol , dvs. en diol med vicinale hydroxylgrupper ). Med udgangspunkt i et a, ω-dialdehyd opnås cykliske 1,2-dioler analogt ved en intramolekylær reaktion.
Individuelle beviser
- ↑ Duden, German Universal Dictionary, 4. udgave, Mannheim, 2001.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. udgave. (Internetversion: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-1 - 3-523.
- ^ Siegfried Hauptmann : Organisk kemi. 2. gennemgået udgave, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, s. 565, ISBN 3-342-00280-8 .
- ↑ a b Wolfgang Legrum: Dufte, mellem stank og duft. Vieweg + Teubner Verlag (2011) s. 82-85, ISBN 978-3-8348-1245-2 .
- ↑ Werner Köhler, Rainer Ansorg: Medicinsk mikrobiologi. Elsevier, Urban & Fischer Verlag, 2001, ISBN 3-437-41640-5 , s.92 .
- ↑ KPC Vollhardt, NE Schore: Organisk kemi . Red.: H. Butenschön. 4. udgave. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, ISBN 3-527-31380-X , s. 862-863 .